以海水为原料制取金属镁的生产步骤的顺序正确的是
①过滤 ②加盐酸 ③浓缩结晶 ④加入熟石灰 ⑤电解熔融的MgCl2
| A.①②③④⑤ | B.④①②③⑤ |
| C.③②④①⑤ | D.②①③⑤④ |
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:
若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是( )
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3—+3HSO3—===3SO42—+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快。下图为用ClO3—在单位时间内的物质的量浓度的变化来表示该反应的速率一时间图象。下列说法不正确的是( )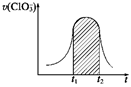
| A.反应开始时速率增大可能是c(H+)增大引起的 |
| B.纵坐标为v(H+)的速率—时间曲线与图中曲线能完全重合 |
| C.后期反应速率下降的主要原因是反应物的浓度减小 |
| D.图中的阴影部分“面积”为t1~t2时间内ClO3—的物质的量浓度的减小值 |
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是( )
| A.正极反应式为:O2+2H2O+4e-===4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2===2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是( )
| A.SO2为0.4 mol/L,O2为0.2 mol/L | B.SO2为0.25 mol/L |
| C.SO3为0.4 mol/L | D.SO2、SO3均为0.15 mol/L |
下列实验中,反应速率加快是由催化剂引起的是( )
| A.在炭粉中加入KClO3,点燃时燃烧更为剧烈 |
| B.锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快 |
| C.固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 |
| D.双氧水中加入少量MnO2,即可迅速放出气体 |