已知拆开1mol H—H键, 1mol N三N键分别需要吸收的能量为436kJ , 946kJ;形成1mol N—H键,会放出能量391kJ,在反应N2 + 3H2 2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ(各2分)。
2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ(各2分)。
(7分)如图所示:在上述转化关系中,已知B、D都是淡黄色固体,且A与D可反应生成离子化合物A2D。回答: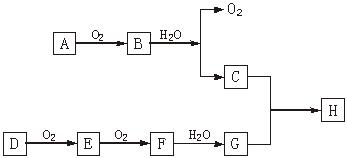
(1)写出下列物质的化学式A._______,H._______。
(2)写出C的电子式_______,B中含有的化学键类型是
(3)写出E→F的化学方程式。
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的原子结构示意图为;M在元素周期表中的位置为;前五种元素的原子半径从大到小的顺序是(用元素符号表示)。Z、L两元素的第一电离能大小关系为:>(填写元素符号),原因是。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子构型为,B的结构式为。
(3)N是人体必需的微量元素,与L同一主族,N原子比L原子多两个电子层,则N的电子排布式为,其最高价氧化物对应的水化物化学式为。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1mol H2N反应热的是__________(填字母代号)。
| A.+99.7 mol·L-1 | B.+29.7 mol·L-1 |
| C.-20.6 mol·L-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出阳极生成R的电极反应式:;由R生成Q的化学方程式:。
某无色溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液做如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液。
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体A生成,同时析出白色沉淀甲;
③在②所得溶液中再加入过量Ba(OH)2溶液,也有气体B生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是;一定存在的离子是。可能存在的离子是。
(2)写化学式:A:;B:;甲: ;乙中一定含,可能含。
;乙中一定含,可能含。
(3)碳酸氢 铵溶液与过量Ba(OH)2溶液反应的离子方程式:
铵溶液与过量Ba(OH)2溶液反应的离子方程式: 。
。
氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)下列有关反应方程式不正确的是(填选项标号)。
A.(CN)2和NaOH溶液反应:(CN)2 + 2OH-= CN-+ CNO-+ H2O
B.MnO2和HCN反应:MnO2 + 4HCN  Mn(CN)2 + (CN)2↑ + 2H2O
Mn(CN)2 + (CN)2↑ + 2H2O
C.向KCN溶液中加入碘水:I2 + 2KCN =" 2KI" + (CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2 + 2Br-= 2Cl-+ Br2
(2)HCN的电子式为。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为(填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b=。
已知下列热化学方程式:①H2(g) + O2(g)=H2O(l) ΔH="-285" kJ·mol-1
O2(g)=H2O(l) ΔH="-285" kJ·mol-1
②H2(g) + O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1③C(s) +
O2(g)=H2O(g) ΔH="-241.8" kJ·mol-1③C(s) + O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
O2(g)=CO(g) ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH="-393.5" kJ·mol-1回答下列问题:
(1)H2的燃烧热为;C的燃烧热为。
(2)燃烧1gH2生成液态水,放出的热量为。
(3)写出CO燃烧的热化学方程式。