氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2和水反应可生成HCN和HCNO;(CN)2的氧化性比Br2弱,比I2强。
(1)下列有关反应方程式不正确的是 (填选项标号)。
A.(CN)2和NaOH溶液反应:(CN)2 + 2OH-= CN-+ CNO-+ H2O
B.MnO2和HCN反应:MnO2 + 4HCN  Mn(CN)2 + (CN)2↑ + 2H2O
Mn(CN)2 + (CN)2↑ + 2H2O
C.向KCN溶液中加入碘水:I2 + 2KCN =" 2KI" + (CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2 + 2Br-= 2Cl-+ Br2
(2)HCN的电子式为 。
(3)处理含CN-(其中C为+2价)的工业废水常用ClO-氧化,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b= 。
短周期元素W、X、Y和Z的原子序数依次增大。金属元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。
(1)W元素的原子核外共有________ 种不同运动状态的电子、_______ 种不同能量的电子。
(2)元素Z与元素X形成共价化合物XZ2是________(选填“极性”或“非极性”)分子,其电子式为 ________________。
(3)Y原子的最外层电子排布式为________________,Y元素最高价氧化物对应的水化物的电离方程式为 ________________________________________________。
(4)两种非金属元素中,非金属性较强的元素是_______(写元素符号),试写出一个能说明这一事实的化学方程式________________________________________________。
b-羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图。每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
(1)每个十二元环平均拥有个锗原子,个氧原子。
(2)试写出Ge-132的化学式。
有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______晶体。
(2)B的氢化物的电子式为,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为,属______分子,其晶体类型是______晶体。俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)。
(5)C和D的化合物溶于水后滴入过量KOH,现象是,离子方程式。
二氧化硅晶体中,每个Si原子周围结合个O原子;同时,每个O原子跟个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按的比例所组成的立体网状结构;晶体中最小的环是由个Si原子和个O原子组成的元环;1mol SiO2中含molSi—O键。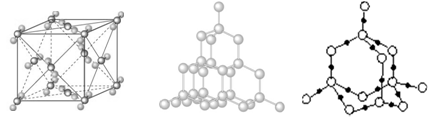
干冰晶胞金刚石晶体结构二氧化硅晶体结构
金刚石晶体中每个碳原子都采取杂化,被相邻的个碳原子包围,以共价键结合形成;晶体中最小的碳环由个碳组成,且同一平面内;晶体中每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为;1mol金刚石中含有molC—C键。