b-羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图。每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(-CH2CH2COOH),各片层间存在相互作用,连结成三维网状结构。
(1)每个十二元环平均拥有 个锗原子, 个氧原子。
(2)试写出Ge-132的化学式 。
过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: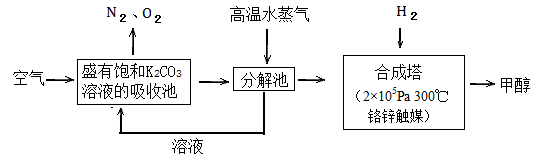
(1)写出吸收池中主要反应的离子方程式;
在合成塔中,若有2.2kgCO2与足量H2 恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式。当电子转移的物质的量为时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。
某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)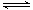 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是 (答出两点即可)。
(答出两点即可)。
D、E为中学化学常见的金属单质,F是一种黑色晶体。E与C的浓溶液在常温作用无明显现象,加热时则有大量无色气体产生,同时生成H。在一定条件下C、D间能发生反应。各物质转化关系如下图: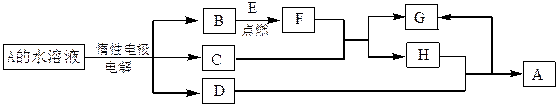 (1)B的同素异形体的名称为_________;F的化学式为__________。
(1)B的同素异形体的名称为_________;F的化学式为__________。
(2)写出D与C的浓溶液反应的化学方程式。
(3)用惰性电极电解A 溶液的阳极反应式为____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是_________。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准 状况下的气体体积为_____________。
状况下的气体体积为_____________。
有机物A~F之间的转化关系如下图所示(部分产物已略去),其中B的相对分子质量是D的2倍。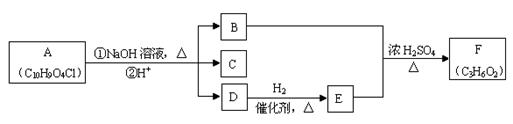
提示: 会自动脱水形成R—CHO
会自动脱水形成R—CHO
根据以上信息回答下列问题:
⑴B的分子式是
⑵检验D中官能团可 使用的试剂名称是,写出D的相邻同系物与该试剂反应的化学方程式______________________________________________________。
使用的试剂名称是,写出D的相邻同系物与该试剂反应的化学方程式______________________________________________________。
⑶C遇FeCl3溶液显紫色,核磁共振氢谱中有四个峰,其峰面积比为1:2:2:1。写出
C的结构简式_____________________。
⑷符合下列条件的C的同分异构体共有种。
①苯环上存在对位取代基;②遇FeCl3溶液显紫色;③能与银氨溶液反应。
⑸写出A的结构简式__________________________。
⑹若1molA 和足量NaOH反应,最多能消耗___________mol NaOH。
和足量NaOH反应,最多能消耗___________mol NaOH。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子的空间结构为;
(2)X单质与水发生主要反应的方程式为;
(3)化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳 酸二甲酯分子中,碳原子采用的杂化方式有
酸二甲酯分子中,碳原子采用的杂化方式有 ,O-C-O的键角约为;
,O-C-O的键角约为;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=;
(5)含有元素Z的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。
晶体硅是信息科学和能源科学的一种重要材料,可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法:
请回答下列问题:(各元素用相应的元素符号表示)
⑴在上述生产过程中,属于置换反应的有(填反应的代号“I~IV”)
⑵A、B、C三种气体,在上述生产过程中可循环利用的是;在“节能减排”
中作为减排目标的一种气体是。
⑶化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和
造纸工业上的黏合剂,可作肥皂的填料,是天然水的软化剂。将石英砂和纯碱按一定比例
混合加热至1373~1623K反应生成化合物甲,其化学方程式为。
⑷利用反应III能制得纯硅的原因是。
⑸已知反应IV中产物的总能量比反应物的总能量低,则在密闭容器内反应IV建立
平衡,改变下列的一个条件,气体B的物质的量增大的是。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
⑹金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成
与分解可以制得纯度很高的纳米镍,写出Ni(A)4在423K分解的化学方程式