. (6分)碳族元素包括C、Si、Cu、Sn、Pb。
(1)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角 120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为 ,每个Ba2+与 个O2-配位。
某金属氯化物MCl227g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为,金属M的相对原子质量为。
除去括号内的杂质,写出所加试剂的化学式
⑴Cl-(SO42-):⑵SO42-(CO32-):⑶Fe2+(Cu2+):
用于分离或提纯物质的方法有:
| A.蒸馏(分馏) | B.萃取 | C.过滤 | D.重结晶 E.分液。 |
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙(2)分离四氯化碳与水的混合物
(3)分离汽油和煤油(4)分离碘水中的碘单质
(5)KNO3晶体中含有少量食盐。
下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。請根据此表,结合学过的化学知识,回答下列问题:
| 配料表 |
精制海盐、碘酸钾(KIO3) |
| 含碘量 |
20―40mg/kg |
| 储藏方法 |
密封避光、防潮 |
| 食用方法 |
烹调时待食品熟后加入碘盐 |
据物质分类中的树状分类法有关知识,在① HIO3② 碘酸钠 ③ KOH ④ I2O5 ⑤ NaCl五种均属于(填“混合物”或“化合物”或“盐”或“氧化物”),其中与碘酸钾(KIO3)属于同类物质的有 _________(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时。
请用物质的组号填写下表。
| 类型 |
同位素 |
同素异形体 |
同分异构体 |
同系物 |
| 组号 |
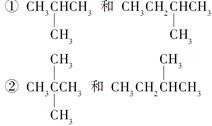
③CH4和CH3CH2CH3
④金刚石和石墨
⑤H、D、T
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3
⑦臭氧(O3)和氧气(O2)