A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象: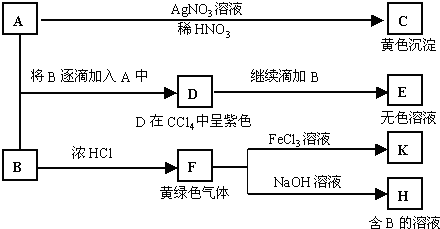
请回答:
(1)写出A和C的化学式:A C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
_________________________________、___________________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:_____________________________。
(4)写出由F→H的化学方程式:__________________________________________。
Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2= -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 = 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。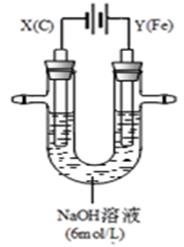
查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
(1)取 300mL 0.2mol/L 的 KI 溶液与一定量的酸性 KMnO4溶液恰好反应,生成等物质的量的 I2 和 KIO3,则消耗 KMnO4 的物质的量的是 mol。
(2)在 Fe(NO3)3溶液中加入 Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 。
(3)在 100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有 1/4的 Br-被氧化成单质 Br2,则原 FeBr2 溶液中 FeBr2的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ ___________________。向反应后的溶液中通入过量CO2,反应的离子方程式为________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
(1)已知下列反应在一定条件下可以发生:
H2O2+2 Fe 2++2 H+===2 Fe3++2 H2O,H2O2+2 Fe3+===2 Fe 2++ O2↑+2 H+。
在以上反应中Fe 2+实际上起着 作用,总反应式为 。
(2)I2也与Fe 2+一样发生上述类似反应,类比(1)在下面横线上填入配平的合适的化学反应方程式:H2O2+I2===2HIO , 总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2I-===I2+ O2↑+2 H+,这个方程式正确吗? 。(填“正确”或“不正确”),理由是 ;
正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式) 。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的离子方程式________________________, 。
(2)滤液Ⅰ中加入CaO生成的沉淀是___________,反应2的离子方程式为_____________。
(3)E可作为建筑材料,化合物C是___________,写出由D制备冰晶石的化学方程式____________。
(4)电解制铝的化学方程式是______________,以石墨为电极,阳极产生的混合气体的成分是___________。
天宫一号于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式:2KNO3+S +3C ="=" K2S +N2 ↑+3CO2 ↑。
①上述反应中的氧化剂是 ;若有0.5 mol S参加反应,则转移的电子的物质的量为 mol;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式 ;
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清。变浑浊的物质是 (化学式表示);
设计实验方案证明该澄清液中含有Cl- 。
(2)1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式 ;
(3)火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式 ;
另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式 。