有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______晶体。
(2)B的氢化物的电子式为 ,属______分子。(极性或非极性)
(3)A和B形成化合物的分子空间构型为 ,属______分子,其晶体类型是______晶体。俗名______。
(4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示) 。
(5)C和D的化合物溶于水后滴入过量KOH,现象是 ,离子方程式 。
下表是某种常见金属的部分性质:
| 颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 银白色固体 |
较软 |
2.70 g·cm-3 |
660.4 ℃ |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投入稀盐酸中,可产生大量的无色气体。根据上述信息完成下列问题:
(1)试推断该金属可能的一种用途________,该金属的活动性比铜_____________(填“强”或“弱”)。(2)请自选试剂,设计实验探究该金属与铁的活动性强弱,并完成下表:
| 猜想 |
验证方法 |
实验现象 |
| 该金属比铁活泼 |
||
| 该金属活泼性比铁弱 |
粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。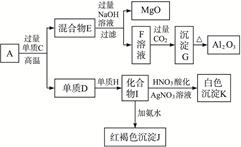
请完成下列问题:
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________。
(3)写出由F生成G的离子方程式:________。
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为_________。
(5)若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A,恰好与含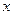 mol HCl的盐酸完全反应,则
mol HCl的盐酸完全反应,则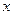 的取值范围是___________(保留小数点后两位)。
的取值范围是___________(保留小数点后两位)。
据说古代有一队运输纯碱的车队,夜晚在沙滩上用纯碱块和石块打起炉灶烧火做饭,第二天清晨日出时,在炉灶处发现有些明晃晃的东西
(1)你认为明晃晃的东西是______________。
(2)写出整个过程中的化学方程式:____________。
(8分)已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+4,试填下表:
| 元素 |
价电子构型 |
族 |
金属或非金属 |
电负性相对高低 |
| 甲 |
||||
| 乙 |
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g) Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。
Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值,平衡常数K值(均选填“增大”“减小”或“不变”)。
(2)1 100 ℃时测得高炉中[CO2]="0.025" mol·L-1,[CO]="0.1" mol·L-1,在这种情况下,该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率v(正)v(逆)(填“大于”“小于”或“等于”),其原因是。