粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如下图所示的转化关系。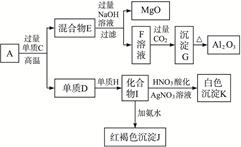
请完成下列问题:
(1)单质C和H的化学式分别是__________、__________。
(2)写出由I生成J的离子方程式:_____________。
(3)写出由F生成G的离子方程式:________。
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为_________。
(5)若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A,恰好与含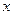 mol HCl的盐酸完全反应,则
mol HCl的盐酸完全反应,则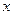 的取值范围是___________(保留小数点后两位)。
的取值范围是___________(保留小数点后两位)。
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1) 海水中盐的开发利用:
Ⅰ.海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和_______池。
II.目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用____________________________________________。(写一点即可)
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如下图所示。请回答后面的问题: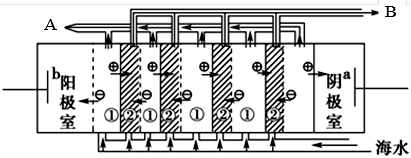
Ⅰ.海水不能直接通入到该装置中,理由是_____________________________________________。
Ⅱ. B口排出的是________(填“淡水”或“浓水”)。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下: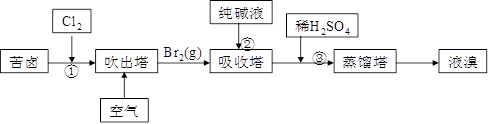
Ⅰ.若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为_____________
_________________________________________。
Ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?_____________________________________________________________________。
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在900C左右进行蒸馏的原因是___________________________________________________________________________。
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g)△H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是(写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO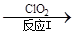 NO2
NO2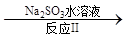 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H0 (填“>”、“<”或“无法确定”);催化剂表面积S1S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H0 (填“>”、“<”或“无法确定”);催化剂表面积S1S2 (填“>”、“<”或“无法确定”)。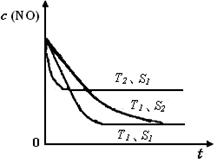
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是____________________________。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为____________;甲溶液中各离子浓度由大到小的顺序为________________(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为_________________________________________。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为________;实验测得丁溶液显弱酸性,由此你能得出的结论是___________________。
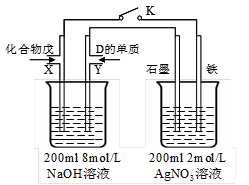
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池
|
(如图),试分析:
HPE是合成苯氧基丙酸类除草剂的重要中间体,其合成路线如下:
已知:① ②
②
据此回答下列问题:
(1)B中含有的官能团名称为,D的结构简式为。
(2)C + E F的反应类型为。
F的反应类型为。
(3)M的核磁共振氢谱中各吸收峰的面积之比为。
(4)写出G + M HPE的化学方程式。
HPE的化学方程式。
(5)X是G的同分异构体,其中满足以下条件的X共有种,写出其中一种X的结构简式 。
| A.苯环上有3个取代基且苯环上的一氯取代物有两种 |
| B.遇FeCl3溶液发生颜色反应 |
| C.X不能与NaHCO3反应产生CO2 |
| D.1 mol X最多能和3 mol NaOH反应 |
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为,其中心原子采取杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为(写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物
质,该反应的离子方程式为。
(5)Z原子基态时的外围电子排布式为;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶体中氧原子与钡原子的最近距离为cm。(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)