Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示):
(1)Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,化合物M的空间构型为 ,其中心原子采取 杂化;Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂,化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物
质,该反应的离子方程式为 。
(5)Z原子基态时的外围电子排布式为 ;已知Z的一种含氧酸钡盐的密度为ρ g.cm-3,其晶胞的结构如图所示,则晶 体中氧原子与钡原子的最近距离为 cm。(只要求列算式, 不必计算出数值。阿伏伽德罗常数为NA)
医药阿斯匹林的结构简式如图。试回答:
⑴ 阿斯匹林可看成酯类物质,口服后在胃肠作用下,阿斯匹林发生水解反应,生成A和B两种产物。其中A的结构简式如图,则
|
阿斯匹林的分子式为: 
X、Y、Z、W四种元素在元素周期表中序数逐渐增大。X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W的元素符号分别是:、、、。
(2)W的最高价氧化物对应的水化物的电子式为。Y的气态氢化物的结构式为。
(3)写出Y的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式 。
下表是元素周期表的一部分,完成以下有关问题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)在①~⑩元素中,最不活泼的元素是_____(写元素符号,下同);最高价氧化物对应的水化物的酸性最强的元素是,最高价氧化物对应的水化物的碱性最强的元素是。
(2)②、③、④的氢化物中最稳定是(填该氢化物化学式)。
(3)④⑤⑥的原子半径从大到小的顺序是>>(写元素符号) 。
(4)①的一种氢化物的产量是衡量一个国家石油化学工业发展水平的标志,该氢化物与⑨的氢化物反应的化学方程式为。
(1)在右图的银锌原电池中,银为极,电极上发生的是反应(“氧化”或“还原”),电极反应式是。锌片上观察到的现象为,电极反应式为。
(2)若反应过程中有0.2mol电子发生转移,则生成的铜为g 。
已知: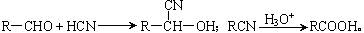
某企业合成高效、低毒农药杀灭菊酯的路线如下: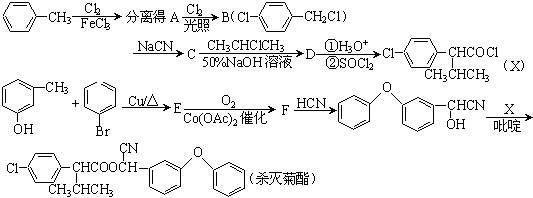
(1)写出下列物质的结构简式:
C______________;D______________;E______________;F______________。
(2)从甲苯到D的四步反应中有________步是取代反应。
(3)农药杀灭菊酯的分子式为__________________。
(4)写出E→F的化学方程式____________________________________。