存在于茶叶中的芳香族化合物A,其氧元素的质量分数为29.27%,相对分子质量不超过170,苯环上的一氯代物有两种。1mol A分别与足量的NaHCO3溶液和NaOH溶液反应,消耗的两种物质的物质的量之比为1:2。
(1)写出下列物质的结构简式:
C D
(2)A中含氧官能团的名称是
B物质不能发生的反应类型有 (填选项)
①取代反应 ②加成反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥水解反应 ⑦酯化反应
(3)写出下列反应的化学方程式:
A→E:
F→G:
(4)芳香醇R的所有含有苯环的同分异构体(不包括R)有 种。
依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,1g丙醇(C3H7OH)燃烧生成CO2和液态水时放热52.68kJ。则表示丙醇燃烧热的热化学方程式为 ____________
②若适量的N2和O2完全反应,每生成6克NO需要吸收6.8kJ热量。_________ ____
③用NA表示阿伏加德罗常数,在C3H6(气态)完全燃烧生成CO2和液态水的反应中,每有9NA个电子转移时,放出741kJ的热量______________。
④已知火箭燃料液态二甲基肼(CH3—NH—NH—CH3)的完全燃烧30克,产生液态水放出热量898.2kJ,则关于二甲肼燃烧热的热化学方程式__ ___
(1)相对分子质量为72的烷烃的分子式是_____________,
(2)该烷烃在空气中燃烧的化学反应方程式是 ,
(3)它可能的结构简式是 。
已知NO2和N2O4之间发生可逆反应: 2NO2 (g) (红棕色) N2O4(g) (无色)
(1)在烧瓶A和B中盛有相同浓度的NO2和N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。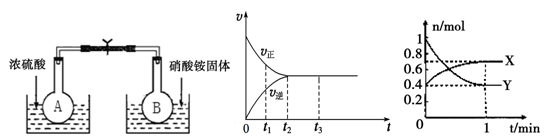
分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中 。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生化学平衡的移动。下列条件的改变,能使该反应化学平衡正向移动的是 。
a.及时分离出NO2气体 b.适当降低温度
c.增大压强 d.选择高效催化剂
(2)下图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是 。
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某容积2L的密闭容器中充入一定量的NO2和N2O4的混合气体,在一定温度压强下,两者物质的量随时间变化如图所示。
①表示NO2变化的曲线是 (填“X”或“Y”)。
②在0到1 min内用Y的浓度变化表示的该反应的反应速率是 mol•L-1•min-1
③计算该反应平衡时化学反应平衡常数K= 。
(11分)现有反应:
A.CaCO3 CaO+CO2↑ CaO+CO2↑ |
| B.Zn+H2SO4=ZnSO4+H2↑ |
C.C+CO2 2CO 2CO |
| D.2KOH+H2SO4=K2SO4+2H2O |
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合下图的是 (填反应序号)。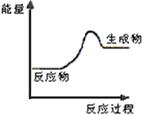
(2)在常温下,上述四个反应中可用于设计原电池的是 (填反应序号),根据该原电池回答下列问题:
①负极材料是 ,负极发生 (填“氧化”或“还原”)反应;正极反应式为 。
②当导线中有1 mol电子通过时,理论上发生的变化是 (填序号)。 (相对原子质量:H1,Zn65)
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如下图所示。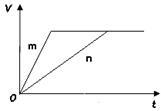
①m曲线表示锌与稀硫酸 (填“X”或“Y”)反应。
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是(填序号)。
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42-)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
下表列出了断裂某些化学键所需的能量:
| 化学键 |
H—H |
Cl-Cl |
I—I |
O=O |
O—H |
H-Cl |
H—I |
| 断裂1 mol化学键所吸收的能量(kJ) |
436 |
247 |
151 |
x |
463 |
431 |
299 |
请回答下列问题:
(1)如图表示某反应的能量变化关系图,此反应为______(填“放热”或“吸热”)反应,其中ΔH=______kJ·mol-1(用含C和D的字母表示)。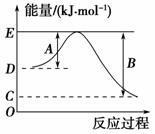
(2)若此能量变化关系图表示反应H2(g)+1/2O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1,则B=_______kJ·mol-1,x=_____。
(3)表示Cl2与HI气体反应生成碘蒸气与氯化氢的____________。