磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO- 4、HPO2- 4、PO3- 4等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分布分数)也可能发生变化。图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线。用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2。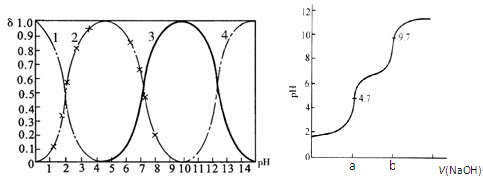
图1 H3PO4粒子分部分数与pH关系 图2 H3PO4滴定曲线(部分)
(注:图中曲线1表示H3PO4、曲线2表示H2PO- 4、曲线3表示HPO2- 4、曲线4表示PO3- 4)
(1)H3PO4第一步电离的电离常数K1的表达式为_______,K1的数值最接近(填字母)______。
| A.10-2.1 | B.10-4.7 | C.10-7 | D.10-9.7 |
(2)用NaOH滴定H3PO4,写出反应从a点到b点的离子方程式____________________,当滴定至pH=7时,溶液主要存在的阴离子(OH-除外)有_______________。
(3)在Na3PO4溶液中,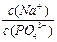 ____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
(4)磷酸钙、磷酸一氢钙和磷酸二氢钙是三种重要的磷酸盐,在食品、化肥等方面应用广泛。其20℃时溶解度数据如下表:
| 名称 |
化学式 |
20℃时溶解度(g) |
| 磷酸钙 |
Ca3(PO4)2 |
2×10-3 |
| 磷酸一氢钙 |
CaHPO4 |
4.3×10-3 |
| 磷酸二氢钙 |
Ca(H2PO4)2 |
1.8 |
磷酸钙在水中溶解度很小,但易溶于稀盐酸。结合平衡移动原理分析其原因
_________________________________________________________________。
(13分)(1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步。火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备。
①用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g)△H="10.7kJ·" mol-1[
N2H4(g)+02(g)=N2(g)+2H20(g)△H="-543" kJ· mol-1
写出气态肼和N2O4反应的热化学方程式为.
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断由二氧化氮制取四氧化二氮的反应条件(或措施):。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图l所示装置中,以稀土金属材料做惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y203的Zr02固体,它在高温下能传导阳极生成的02-离子(02+4e →202-)。
①c电极的名称为,d电极上的电极反应式为。
②如图2所示电解l00mL0.5 mol·L-1CuS04溶液,a电极上的电极反应式为
。若a电极产生56mL(标准状况)气体,则所得溶液的pH=(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入(填序号)。
a. CuO b. Cu(OH)2 c.CuC03 d.Cu2(OH)2C03
(l4分)向2L固定容积的密闭容器中加入一定量的NH3,H2和N2三种气体。一定条件下发生反应2NH3 N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
N2+3H2,各物质浓度随时间变化如图1所示。图2为t时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且两个阶段各改变一种不同的条件。
(1)能证明反应达到平衡状态的是(填标号,下同)。
| A.容器内压强不再发生变化 | B.N2的体积分数不再发生变化 |
| C.容器内气体质量不再发生变化 | D.容器内气 体密度不再发生变化 体密度不再发生变化 |
(2)若tl="15" s,则t0-t1阶段以H2浓度变化表示的反应速率为。
(3)t3-t4阶段改变的条件为。
(4)上述反应的平衡常数K=(保留两位小数);向容器中再通入1.4molNH3、0.8 molH2,平衡移动(填“向右”、“向左”或“不移动”)。
(5)25OC时,将a mol·L-1的氨水与0.1 mol·L-1的盐酸等体积混合。
①当溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,则反应的情况可能为
a.盐酸不足,氨水剩余 b. 氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数Kb=  。
。
(13分)安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、0四种元素。
(1)氧元素在元素周期表中的 位置是,Na原子结构示意图为,其中三种主族元素的离子半径从大到小的顺序是(用离子符号表示)
位置是,Na原子结构示意图为,其中三种主族元素的离子半径从大到小的顺序是(用离子符号表示)
(2)水溶性实验表明,安全气囊中固体粉末部分溶解。不溶物为一种红棕色固体,可溶于盐酸。已知该不溶物能发生铝热反应,写出反应的化学方程式。
(3)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是,其水溶液显性(填“酸”、“碱”或“中”),原因是 (用离子方程式表示)。
(用离子方程式表示)。
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。F的水溶液为浅绿色。物质D的焰色为黄色。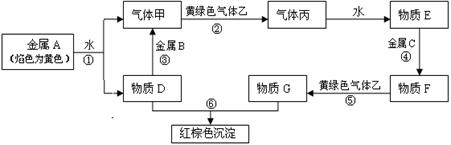
回答下列问题:
(1)写出下列物质的化学式:CGD
(2)写出反应③的离子方程式:。
(3)描述F溶液中滴加D溶液后的现象 。
(共8分) A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、
Na+、Cu2+中的某一种,阴离子分别可能是 、S
、S 、Cl—、C
、Cl—、C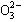 的某一种。
的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1) 、(2)实验事实可推断它们的化学式为:
A.B.C.D.