某温度下,将Cl2通入NaOH溶液中,反应得到NaCl.NaClO.NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
| A.21:5 | B.11:3 | C.3:1 | D.4: 1 |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) |
| C.常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol·L-1 |
| D.物质的量浓度之比为1∶2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
1L |
1L |
2L |
| 温度 |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1molA 2molB |
1molA 2molB |
4molA 8molB |
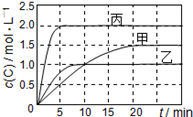
下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T1时该反应的平衡常数K=7.2
C.前10min甲、乙、丙三个容器中A的反应速率:v(A)甲=v(A)乙<v(A)丙
D.平衡时A的质量m:m乙<m甲<m丙
向FeI2溶液中滴加适量氯水,将反应后溶液分3份,甲试管中滴加淀粉溶液,乙试
管滴加KSCN溶液,丙试管中滴加酸性高锰酸钾溶液,下列说法正确的是
| A.若甲试管溶液呈蓝色,则乙试管溶液一定呈血红色 |
| B.若甲试管溶液呈蓝色,则乙试管溶液可能无明显现象 |
| C.乙试管溶液呈血红色,则甲试管溶液不可能呈蓝色 |
| D.甲试管溶液呈蓝色,丙试管中紫红色褪去,说明滴加氯水后的溶液中一定 |
存在Fe3+和Fe2+
向含溶质0.2mol的Al2(SO4)3溶液中加入1000mL KOH溶液,生成白色沉淀7.8g ,则KOH溶液的物质的量浓度可能为
| A.0.3mol/L | B.0.7mol/L | C.0.8 mol/L | D.1.5mol/L |
证明生石灰中既混有石英、又混有石灰石的正确方法是
| A.加入过量盐酸,观察是否有气泡冒出 |
| B.加入过量烧碱溶液,观察是否有固体溶解 |
| C.加热至高温、观察是否有气泡冒出,是否有硅酸钙生成 |
| D.先加过量盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有不溶物则滤出,投入到氢氧化钠溶液中看其是否溶解 |