下表是部分短周期元素的原子半径及主要化合价,根据表中的信息,判断以下叙述正确的是: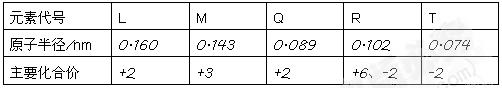
| A.L2+与R2—的核外电子数相等 | B.M与T形成的化合物具有两性 |
| C.氢化物的稳定性为H2T<H2R | D.单质与浓度相等的稀盐酸反应的速率Q>L |
下列有关钢铁腐蚀和防护的说法不正确的是
| A.自行车的钢圈上镀一层铬,防止生锈 |
| B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连 |
| C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=4OH- |
| D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=Fe3+ |
(10分)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子的外围电子排布式为。
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式、。
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③ 、④HCHO,其中碳原子采取sp2杂化的分子有
、④HCHO,其中碳原子采取sp2杂化的分子有
(填物质序号),HCHO分子的立体结构为形。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为。
(5)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如上右图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键。
氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为
| A.直线 sp杂化 | B.V型 sp2杂化 |
| C.三角锥形 sp3杂化 | D.平面三角形 sp2杂化 |
由第一电离能数据推断,最有可能生成稳定的单核阳离子的元素是
| 氟 |
氯 |
溴 |
碘 |
|
| 第一电离能(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
A.氟 B.氯 C.溴 D.碘
HNO3中N原子轨道的杂化类型为
| A.sp1 | B.sp2 | C.sp2 | D.sp3 |