已知A、B、C是1~18号元素中的3种,0.5molA元素的离子得到6.02×1023个电子被还原为中性原子,0.8gA的氧化物恰好与100mL0.4mol/L的盐酸完全反应,A原子核内质子数与中子数相等。3.6gB元素的单质和足量的硫酸反应,放出氢气4.48L(标准状况),C得到一个电子后与氩的电子层结构相同,其最高价氧化物的水化物为自然界最强的酸。 (1)写出三种元素的符号:A B______ C______
(1)写出三种元素的符号:A B______ C______
(2)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是___________ ,
离子反应方程式为___________ 、 。
将生成物过滤、洗涤、干燥灼烧,可得白色固体质量为 。
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);ΔH1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH
(l);ΔH2=-Q2 kJ/mol,H2O(g)=H2O(l);ΔH3=-Q3 kJ/mol。若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为 ________________kJ。
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内
熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题: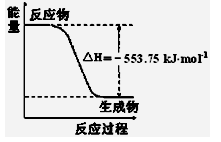
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式。
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:__________________________________________。
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4 g,在该含氧酸盐中金属的化合价为 ____,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是 __g(结果精确至0.01 g)。
④二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 ____。
.已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为,1mol M中含有σ键的数目为。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是。
(3)写出与BD2互为等电子体的C3-的结构式。
(4)E+的核外电子排布式为,下图是E的某种氧化物的晶胞结构示意图,氧的配位数为。
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为。
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池。
其电池总反应为:
V3++VO2++H2O VO2++ 2H++V2+。
VO2++ 2H++V2+。
充电过程中,H+向迁移(填“阴极区”或“阳极区”)。充电时阴极反应式为。
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
该反应的化学平衡常数表达式为K=。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如上图所示。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件
可能是(填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为。
(12分) 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为极,该极的电极反应式是,电池工作一段时间后,电解质溶液的pH将(填“增大”、“减小”、“不变”)。
(2)肼用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式。
(3)肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0kg还原产物时,计算参加反应的肼的质量 (写出计算过程) 。
多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受。多巴胺可用香兰素与硝基甲烷等为原料按下列路线合成。
(1)C中的含氧官能团的名称是、。
(2)反应①、④的反应类型分别为、。
(3)写出由A→M的化学方程式。
(4)写出同时满足下列条件的香兰素的一种同分异构体的结构简式。
①能与碳酸氢钠溶液反应②能与FeCl3溶液发生显色反应
③有5种不同化学环境的氢原子
(5)苯乙胺( )是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
)是生物体中重要的生物碱。写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: