最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: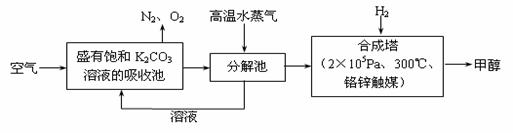
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是 。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)常温下,0.1 mol/L KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:
。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热量,已知:0.8 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,并放出513.3 kJ的热量。
(1)反应的热化学方程式为;
(2)又已知:H2O(g)===H2O(l);△H= —44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是;
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。
在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O
(1)RO3n-中R元素的化合价为;(2)R元素的原子最外层电子数是。
下表是元素周期表的一部分,回答下列问题:
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
11 |
12 |
(1)写出①元素的名称
(2)写出⑨元素的符号
(3)在这些元素中,(用元素符号填写,下同)是最活泼的金属元素;是最活泼的非金属元素;是最不活泼的元素。
(4)这些元素的最高价氧化物的对应水化物中酸性最强;碱性最强;
(5)从⑤到⑪的元素中,原子半径最小。
(6)比较⑤和⑥的化学性质,更活泼,试用实验证明此现象(简述操作、现象和结论)
。
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)ⅡA族元素的最外层电子数________; (2)第3周期元素的最高化合价________;
(3)F-、Na+、Mg2+、Al3+的离子半径________。
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B原子的P轨道半充满,形成氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3P轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为31,F与B属同一主族,E与F形成的化合物常用于制造半导体。根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为(用元素符号表示)。
(2)化合物BD3的分子空间构型是。
(3)上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED),其材料是E与F形成的化合物甲(属于第三代半导体),用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。化合物甲的晶胞结构如右图(白球代表F,黑球代表E)。试回答:
①该晶胞中所包含的F原子(白色球)个数为。
②与同一个E原子相连的F原子构成的空间构型为 。
③下列说法正确的是。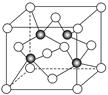
A.该晶胞结构与NaCl相同 B.半导体EB与EF互为等电子体
C.电负性:F>E D.EF晶体中含有配位键
④ (CH3)3E中E原子的杂化方式为。
⑤该晶体中紧邻的F原子之间与紧邻的F、E两原子之间距离的比值为
(写出计算过程)