1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则2molC2H2完全燃烧放出的热量为 kJ;写出C2H2燃烧的热化学方程式: 。
(1)写出一个以离子浓度表示的电荷守恒等式:。
(2)写出一个含有c(OH-)和c(H+)的等式:。
(3)根据Na3PO4中Na、P原子个数关系,写出一个含有c(Na+)和c(PO )的等式:。
)的等式:。
(1)根据电荷守恒,写出一个用离子浓度表示的等式:;
(2)根据水的电离,写出一个含有c(H+)和c(OH-)的等式:;
(3)根据(NH4)2CO3中,C、N原子个数关系,写出一个含有c(NH+4)和c(CO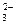 )的等式:。
)的等式:。
某常见有机物式量为92,与足量丙酸完全酯化,所得产物的式量是260。则该常见有机物分子中羟基个数为____________(填数字),其水溶性为____________(填“溶解”或“不溶解”)。
(1)Mr(A)-Mr(B)=;
(2)1个B分子中的O原子个数是______;
(3)A的分子式是______;
(4)B可能的三种结构简式分别是______、______、______。
已知:CH3CH2OH CH3COOCH2CH3
CH3COOCH2CH3
(相对分子质量46) (相对分子质量88)
现只含C、H、O的化合物A~F,有关它们的某些信息,已注明在下面的方框内。
试确定化合物A、F的结构简式:____________、____________。