25 ℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 电离平衡常数 |
1.8×10-5 |
K1 4.3×10-7 K2 5.6×10-11 |
3.0×10-8 |
|
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是_____________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是: ;
a.CO32- + CH3COOH=CH3COO- + CO2 ↑ + H2O
b.ClO- + CH3COOH=CH3COO- + HClO
c.CO32- + HClO=CO2 ↑+ H2O + ClO-
d.2 ClO- + CO2 + H2O=CO32-+ 2 HclO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是_________;
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)

(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:

①原混合溶液中c(H+)=___________________;c(Cl-)=_________________。
②A点的pH=_________________。
③将0.15 mol·L-1稀硫酸V1mL与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
(溶液体积变化忽略不计)。
A为常见烃是一种水果催熟剂,乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。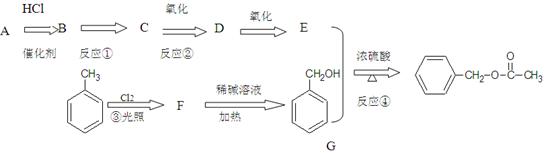
请回答:
(1)E的官能团名称为F的结构简式为
(2)反应①条件为,反应④的类型是
(3)反应②的化学方程式为;反应类型是
(4)物质D与新制氢氧化铜反应方程式为
(5)G有多种同分异构体,其中属于芳香族化合物的有种(不包括G)
写出其中的任意一种同分异构体的结构简式
回答下列问题:
① CH2=CH-CH=CH2 键线式__________②羟基(-OH)的电子式_____________
③ 的结构简式___________④芳香烃萘
的结构简式___________④芳香烃萘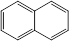 的分子式为
的分子式为
质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_,含有原子数目最多的是,在相同温度和相同压强条件下,体积最大的是。
为了除去NaCl溶液中少量的MgCl2、Na2SO4,从稀盐酸,Na2CO3,K2CO3,Ba(NO3)2,Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中步骤进行操作:
(1)下列试剂的化学式AC
(2)加入过量A的原因是,有关反应的离子方程式是,
(3)加入过量B有关反应的离子方程式是。
按要求写出下列化学反应的方程式:
(1)写出下列化学反应的离子方程式:
①将CO2通入过量的澄清石灰水中,
②将CuO粉末投入稀硫酸中,
(2)写下列离子方程式对应的化学反应的化学方程式:
2H++CO32- = CO2↑+H2O 。