在一恒容密闭容器中发生某化学反应2A(g)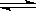 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示: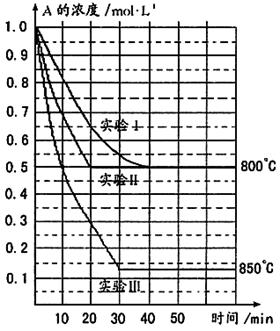
试回答下列问题:
(1)在实验Ⅰ中,反应在20min至40min内A的平均反应速率为___________mol·L-1min-1。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_____________________________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
向2 L密闭容器中通入a mol气体 A和b mol气体B,在一定条件下发生反应;xA(g)+yB(g)  pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率vC=1/2vA;反应2 min时,A的浓度减少了1/3,B的物质的量减少a/2mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,vA=________,vB=__________;
(2)化学方程式中,x=________、y=________、p=______、q=________;
(3)反应平衡时,D为2a mol,则B的转化率为__________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的ΔH________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率____________(填“增大”、“减小”或“不变”),理由是________________________________________________________;
②平衡时反应物的转化率__________(填“增大”、“减小”或“不变”),理由是
_________________________________________________________________;
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________________________________
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①请完成此实验设计,其中:V1=__________,V6=__________,V9=________。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________。
(11分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:
________________________________________________________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是______________。
(3)控制城市空气污染源的方法可以有___________________________________(填字母序号)。
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
(14分)在200℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)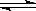 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=_______,c(I2)=_______,而c(HI)=________,所以化学反应速率________最大而________最小(为零)(填“v正”或“v逆”)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v正________,而v逆________(填“增大”、“减小”或“不变”) (3)当反应进行到v正与v逆________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
(9分)氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术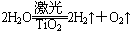 。制得的氢气可用于燃料电池。试完成下列问题:
。制得的氢气可用于燃料电池。试完成下列问题:
(1)太阳光分解海水时,实现了从_______能转化为_______能,二氧化钛作________。生成的氢气,用于燃料电池时,实现________能转化为________能。水分解时,断裂的化学键有________,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:
A极:H2+O2--2e-===H2O;B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。