I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为 。
(2)下列物质中,不可以通过乙烯加成反应得到的是 (填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
II. 在实验室可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。

(3)乙酸分子中官能团的名称分别是 。
(4)试管a中发生反应的化学方程式为 ;反应类型是 。
(5)反应开始前,试管b中盛放的溶液是 。
有一包白色固体,可能由:CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成。为了判断其中的成份,某同学设计了如下实验方案,并 进行了实验现象的假设,请你帮助他对这些假设作一些判断:
进行了实验现象的假设,请你帮助他对这些假设作一些判断:
| 实验步骤 |
实验现象 |
判断 |
| 取固体溶于水 |
①若只得到蓝色溶液 |
一定没有____________________________。 |
| ②若有白色沉淀,静置,上层溶液无色 |
一定没有___________________________。 |
|
| 取②的混 合物过滤 |
③在沉淀中加入盐酸,沉淀部分溶解;过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀 |
一定含有_____________________________, 沉淀中加入盐酸的离子方程式: _______________________________________。 能否确定原固体中是否含有NaCl,并说明理由 _______________________________________ _______________________________________。 |
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
 |
|||||||||||||||||
| A |
B |
C |
|||||||||||||||
| D |
E |
||||||||||||||||
| N |
M |
Q |
|||||||||||||||
⑴A、B、C原子的第一电离能由小到大的顺序是__________(用元素符号表示);
Q元素基态原子电子排布式为。
⑵写出BC2+的电子式,1mol BC2+中含有的π键数目为。
⑶化合物甲由B、D两元素组成,已知甲是一种重要的结构材料,硬度大,耐磨损,晶胞如图1所示甲的晶体中B、D两种元素原子的杂化方式均为。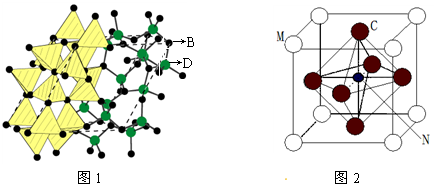
⑷法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔因在巨磁电阻效应(CMR效应)研究方面的成就而获得诺贝尔物理学奖。如图2的化合物具有CMR效应,则该化合物的化学式为。
甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO(g)+2H2(g)  CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为:
CO(g)+ O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
⑴反应Ⅰ的焓变△H1=。
⑵CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4
该反应的焓变△H4=。
与CO和H2相比,甲醇作为汽车动力燃料的优点是
。
⑶反应Ⅰ的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。
既能提高产率,又能提高反应速率的措施是。
⑷甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化 学式)
学式)
②负极的电极反应式为。
还原铁粉是粉末冶金工业的重要原料,利用生产钛 白的副产品绿矾制备还原铁粉的工业流程如下:
白的副产品绿矾制备还原铁粉的工业流程如下: 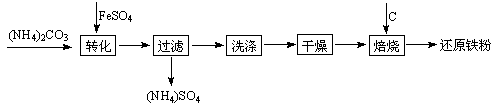
⑴干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为。
⑵取干燥后的FeCO3样品12.49 g焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为,计算FeCO3样品中FeCO3与FeOOH的质量。
⑶若将28.12 g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224 mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752 L,计算FexC的化学式。(假设还原铁粉仅含两种物质)
下图所示转化关系中,B、C、F都是单质,其中C是紫红色固体,F是银白色固体,B是空气的主要成分之一;化合物G是常用的耐火材料,D溶液中加入氯化钡溶液,产生白色沉淀。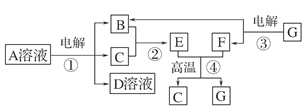
试回答下列问题:
⑴反应①~④中,属于置换反应的是________(填序号)。
⑵写出反应①的化学方程式:_____________________________________________。
⑶G与D溶液反应的离子方程式__________________________________________。
⑷生成等物质的量的B时,反应①和③消耗的A、G的物质的量之比为________。
⑸用C、F作两电极,并用导线相连:
①两电极同时插入稀H2SO4中,F上的电极反应式为
__________ __________________________________________________________。
__________________________________________________________。
②两电极同时插入浓HNO3中,F上的电极反应式为
____________________________________________ ________________________。
________________________。