下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| |
 |
|
|||||||||||||||
| |
|
|
|
A |
B |
C |
|
|
|||||||||
| |
|
|
D |
E |
|
|
|
||||||||||
| |
N |
|
M |
|
Q |
|
|
|
|
|
|
|
|
|
|
|
|
⑴A、B、C原子的第一电离能由小到大的顺序是__________(用元素符号表示);
Q元素基态原子电子排布式为 。
⑵写出BC2+的电子式 ,1mol BC2+中含有的π键数目为 。
⑶化合物甲由B、D两元素组成,已知甲是一种重要的结构材料,硬度大,耐磨损,晶胞如图1所示甲的晶体中B、D两种元素原子的杂化方式均为 。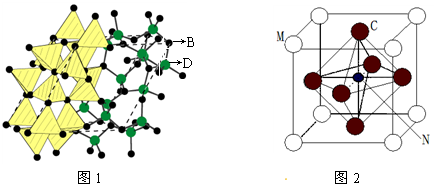
⑷法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔因在巨磁电阻效应(CMR效应)研究方面的成就而获得诺贝尔物理学奖。如图2的化合物具有CMR效应,则该化合物的化学式为 。
氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为;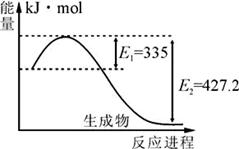
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:
| 实验组 |
温度℃ |
起始量/mol |
2分钟/mol |
平衡常数 |
|
| H2 |
N2 |
NH3 |
|||
| 1 |
298 |
6 |
2 |
1.2 |
4.1×106 |
| 2 |
398 |
3 |
1 |
0.8 |
K1 |
请回答下列问题:
① K1的相对大小,K1_______4.1×106(填写“>”“=”或“<”);
②实验1中以υ(H2) 表示的反应速率为;
③下列各项能作为判断该反应达到化学平衡状态的依据 的是(填序号字母);
的是(填序号字母);
| A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 |
| B.υ(N2)(正)=3υ(H2)(逆) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
(3)在一定条件下合成氨反应达平衡后,在恒容条件下充入氦气,正反应速率(填“增大”“减小”“不变”,在恒压条件下,充入氦气,平衡移动(“正向”“逆向”“不”)
(4) NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为深棕红色液体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
请回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为,如果有1.6gG生成反应过程中转移电子的物质的量是mol;
(3)写出另外一种实验室制取H的化学方程式
(4)工业制硫酸的关键反应是用H跟大气污染物之一的气体物质反应,其反应的化学方程式是,该反应平衡常数表达式是;
(5)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=6.60×10—6。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为。
(1 3分)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
3分)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不同硫酸的原因是 _____________ 。
(2)操作Ⅱ的目的是 ____,溶液A(溶质是共价化合物)是。
(3)写出检验滤液B中是否含NH4+离子方法: _______
_________________________________________________________________________
(4)写出加入碳酸铵所发生反应的离子方程式: _______ 。写出滤液B的一种用途:。
(22分)在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g) CO(g) + H2O(g)其平衡常数K和温度t的关系如下:
CO(g) + H2O(g)其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为:_____ ____
____ _______________;
_______________;
(2) 该反应的正反应为 _______反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是: ________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4)在850℃时,可逆反应:CO2(g) + H2(g) CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O( mol/L) mol/L) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
①前2min,用CO2表示该化学反应的速率是________________________________;
②在3-4mi n之间,反应处于_____________状态(填“平衡”或“非平衡”)。
n之间,反应处于_____________状态(填“平衡”或“非平衡”)。
③计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出计算过程(850℃时,K值从上表可查出;c3精确到小数点后面三位数)。
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: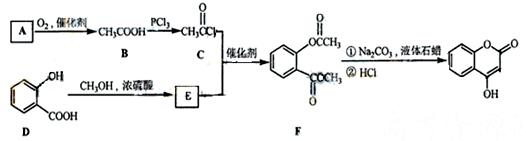
 (1)写出G的含氧官能团的名称_____________________________________;
(1)写出G的含氧官能团的名称_____________________________________;
(2)B→C的反应类型是。
(3)A与银氨溶液反应有银镜生成,则A的结构简式是。写出A和银氨溶液水浴加热反应的化学方程式:______________________________________________;
(4)E的结构简式是
(5)下列关于G的说法正确的是
a.能与溴单质反应b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3