氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为 ;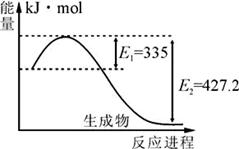
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,得到如下数据:
2NH3(g) △H<0,得到如下数据:
| 实验组 |
温度℃ |
起始量/mol |
2分钟/mol |
平衡常数 |
|
| H2 |
N2 |
NH3 |
|||
| 1 |
298 |
6 |
2 |
1.2 |
4.1×106 |
| 2 |
398 |
3 |
1 |
0.8 |
K1 |
请回答下列问题:
① K1的相对大小,K1_______4.1×106(填写“>”“=”或“<”);
②实验1中以υ(H2) 表示的反应速率为 ;
③下列各项能作为判断该反应达到化学平衡状态的依据 的是 (填序号字母);
的是 (填序号字母);
| A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2 |
| B.υ(N2)(正)=3υ(H2)(逆) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
(3)在一定条件下合成氨反应达平衡后,在恒容条件下充入氦气,正反应速率 (填“增大”“减小”“不变”,在恒压条件下,充入氦气,平衡 移动(“正向”“逆向”“不”)
(4) NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合初中化学和生物学科的知识,回答下列问题。
| 配料表 |
精制海盐、碘酸钾[ |
| 含碘量 |
20~40mg/kg |
| 卫生许可证号 |
××卫碘字(1999)第001号 |
| 分装日期 |
见封底 |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
(1)碘是合成下列哪种激素的主要原料之一()
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患()
A.甲状腺亢进 B.贫血症 C.地方性甲状腺肿大 D.糖尿病
D.糖尿病
(3)食盐中加碘,这碘指的是(填元素、原子或单质)。
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为____________。
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易__________。
(6)已知可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾(进行如下反应:IO3-+5I-+6H+==3I2+3H2O)。现有①纯净水、②白酒、③食醋、④淀粉KI试纸、⑤纯碱,试从中选择必须的物质检验食盐样品中是否加入碘,选择的物质_______________(填序号)。
方程式书写:
(1)镁条在二氧化碳中燃烧的反应:
(2)小块钠投入到水中的离子反应:
实验室配制 500 mL 0.2 mol/L CuSO4 溶液,实验操作步骤有:
溶液,实验操作步骤有:
①用天平称量蓝矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入 500 mL 容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度 1~2 cm处,改用胶头滴管小心滴加少量蒸馏水至溶液凹液面底部与刻度线相切
④用少 量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动
量蒸馏水洗涤烧杯和玻璃棒 2~3 次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)在天平上称出胆矾的质量为g。
(2)操作步骤的正确顺序为(填序号)。
(3)若出现如下情况,所配溶液浓度将有何影响?(填偏高、偏低或无影响)
a.没有进行操作步骤④时,会_______________;
b.定容时俯视刻度线,会__________________。
(4)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应 。
。
现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠四瓶失去标签的溶液,分别编号为A、B、C、D每次取少量溶液两两混合,所观察到的现象如表,“一”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成。
(1)则A,B,
C,D;(写化学式)
(2 )写出实验过程中有关物质间反应的离子方程式
)写出实验过程中有关物质间反应的离子方程式
B +C
如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。试回答:
(1)此实验中,观察到的现象有
① ,
,
②。
(2)写出实验过程中反应的离子方程式。