下图所示转化关系中,B、C、F都是单质,其中C是紫红色固体,F是银白色固体,B是空气的主要成分之一;化合物G是常用的耐火材料,D溶液中加入氯化钡溶液,产生白色沉淀。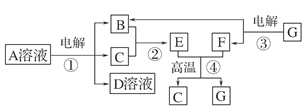
试回答下列问题:
⑴反应①~④中,属于置换反应的是________(填序号)。
⑵写出反应①的化学方程式:_____________________________________________。
⑶G与D溶液反应的离子方程式__________________________________________。
⑷生成等物质的量的B时,反应①和③消耗的A、G的物质的量之比为________。
⑸用C、F作两电极,并用导线相连:
①两电极同时插入稀H2SO4中,F上的电极反应式为
__________ __________________________________________________________。
__________________________________________________________。
②两电极同时插入浓HNO3中,F上的电极反应式为
____________________________________________ ________________________。
________________________。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
用36.5%的盐酸配制20%的盐酸,操作步骤是(依次写出),配制过程中所需的定量仪器是。
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
写出铝、氧化铝分别与盐酸反应的离子方程式:
,,
A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是________________________________________________。A、B、C三元素形成简单离子的半径大小顺序为____________。(用离子符号表示)
比较A、B单质活泼性的实验方法是__________________________________________。
已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元 素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
素,B元素的原子核外M层上的电子数比K层上的电子数多1。解答26-30小题:
1.A原子的结构示意图为__________;A元素在周期表中位置为_____________________。
2.写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式_______________________________________。
3.A和C形成的化合物的电子式为_____________,该化合物的水溶液呈__________性(填“酸”或“碱”)。
“物质结构与性质”
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为。在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为。在四大晶体类型中,GaN属于晶体。
(2)铜、铁元素能形成多种配合物。微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有的原子或离子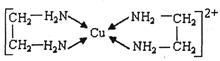
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
① H、N、O三种元素的电负性由大到小的顺序是。
②SO2分子的空间构型为。与SnCl4互为等电子体的一种离子的化学式为。
③乙二胺分子中氮原子轨道的杂化类型为。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
④⑶中所形成的配离子中含有的化学键类型有。
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如右图所示,其中Cl原子的配位数为。