(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ/mol,H—H键的键能是436.0 kJ/mol;由N2和H2合成1 mol NH3时可 放出46.2 kJ的热量。则N—H键的键能是_______________________。
放出46.2 kJ的热量。则N—H键的键能是_______________________。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学方程式:
Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol ①
3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol ②
Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH=+640 .5 kJ/mol ③
.5 kJ/mol ③
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式______________________________。
(3)已知两个热化学方程式:
C(s)+O2(g)=CO2 (g) △H= ― 393.5kJ/mol
(g) △H= ― 393.5kJ/mol
2H2(g)+O2(g )=2H2O(g) △H= ― 483.6kJ/mol
)=2H2O(g) △H= ― 483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是 .
下列各物质:①O2、O3②H2、D2、T2③12C、14C
④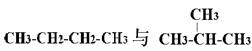 ⑤
⑤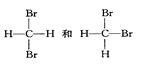
互为同分异构体的是(填序号,下同);互为同位素的是
互为同素异形体的是;是同一种分子的是
在2
密闭容器内,800 ℃时反应:
 ,
体系中,
随时间的变化如表:
,
体系中,
随时间的变化如表:
| 时间(
) |
0 |
1 |
2 |
3 |
4 |
5 |
| 0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)用
表示从0~2
内该反应的平均速率
。 (2)右图中表示
浓度的变化的曲线是。
(2)右图中表示
浓度的变化的曲线是。
(3)能说明该反应已达到平衡状态的是。
A.
B.容器内压强保持不变
C.
逆
=2
正
D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是。
A.及时分离除
气体B.适当升高温度
C.增大
的浓度D.选择高效催化剂
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
(1)已知常温时32g甲烷燃烧放出的热量为akg,写出甲烷标准燃烧热的热化学方程式;
(2)以甲烷为燃料和KOH溶液为电解质制成燃料电池。
其电池负极反应式是:;
其电池总反应化学方程式是:。
已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)25时,将=9的NaOH溶液与=4的溶液混合,混合所得溶液的=7,则NaOH溶液与溶液的体积比为
(2)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(3)95时,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5 ,则HA是(填“强酸”或“弱酸”)