有一包白色固体,可能由:CuSO4、Na2SO4、Na2CO3、Ba(NO3)2、NaCl 中的一种或几种组成。为了判断其中的成份,某同学设计了如下实验方案,并 进行了实验现象的假设,请你帮助他对这些假设作一些判断:
进行了实验现象的假设,请你帮助他对这些假设作一些判断:
| 实验步骤 |
实验现象 |
判 断 |
| 取固体溶于水 |
①若只得到蓝色溶液 |
一定没有____________________________。 |
| ②若有白色沉淀,静置,上层溶液无色 |
一定没有___________________________。 |
|
| 取②的混 合物过滤 |
③在沉淀中加入盐酸,沉淀部分溶解;过滤,在滤液中加入AgNO3溶液和稀硝酸,有白色沉淀 |
一定含有_____________________________, 沉淀中加入盐酸的离子方程式: _______________________________________。 能否确定原固体中是否含有NaCl,并说明理由 _______________________________________ _______________________________________。 |
磷脂含有一个非极性基团和一个极性基团,水溶性的磷脂有重要的生物学功能。磷脂是甘油酯的一个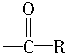 被
被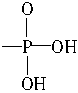 代替后,再与碱反应生成的产物。试将软脂酸和甘油转化成含Na+的磷脂。
代替后,再与碱反应生成的产物。试将软脂酸和甘油转化成含Na+的磷脂。
(1)___________________、(2)______________________、(3)__________________。
下面是一个四肽,它可以看作是4个氨基酸缩合掉3个分子水而得。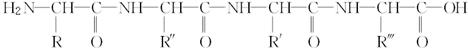
式中,R,R′,R″,R可能是相同的或不同的烃基,或有取代基的烃基;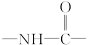 称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸: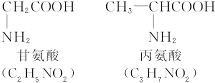
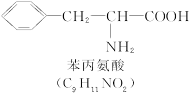
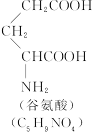
(1)这个“多肽”是___________肽。
(2)该1 mol多肽水解后,有___________mol谷氨酸。
(3)该1 mol多肽水解后,有___________mol苯丙氨酸。
有一新型抗癌药,其分子式为C47H51NO14,它是由如下的酸A和醇反应而生成的一种酯。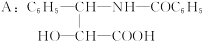
B.R—OH(R是一个含C、H、O的基团)
(1)A在无机酸催化下可水解,其反应方程式为______________________________。
(2)A水解所得到的产物是否是天然蛋白质水解产物?__________,原因是______________。
(3)写出ROH的分子式__________。
α-氨基酸能被HNO2氧化成α-羟基酸,如:
+N2↑+H2O。若丙氨酸可发生如下反应,分别生成A、B、C、D、E五种有机物。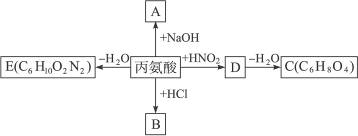
则这些反应产物的结构简式分别为:
A__________;B__________;C__________;D__________;E__________。
氨基乙酸在水溶液中存在如下平衡:
 ,若向氨基乙酸溶液中加入盐酸,则平衡向_________方向移动,有机化合物(写结构简式) _________的浓度增大;若向氨基乙酸溶液中加入NaOH,则平衡向_________方向移动,有机化合物_________的浓度增大。
,若向氨基乙酸溶液中加入盐酸,则平衡向_________方向移动,有机化合物(写结构简式) _________的浓度增大;若向氨基乙酸溶液中加入NaOH,则平衡向_________方向移动,有机化合物_________的浓度增大。