下表是某种常见金属的部分性质:
| 颜色 状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 银白色 固体 |
较软 |
2.70 g·cm-3 |
660.4℃ |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投入稀盐酸中可产生大量的无色气体。试回答:
(1)推断该金属可能的一种用途:________,该金属的活泼性比铜________(填“强”或“弱”)。
(2)请自选试剂,设计不同的实验方案探究该金属与铁的活泼性强弱,并完成下表:
| 猜想 |
验证方法 |
预测实验现象 |
| 该金属比铁活泼 |
|
|
| 该金属活泼性比铁弱 |
|
|
工业上用甲苯生产对羟基苯甲酸乙酯 ,其生产过程如下图,根据下图回答:
,其生产过程如下图,根据下图回答: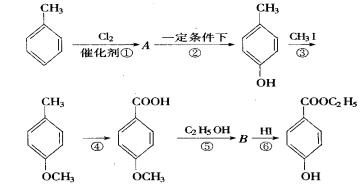
(1)有机物A的结构简式为。
(2)反应⑤的条件是
(3)反应②的反应类型是(填编号,下同),反应④的反应类型属。
| A.取代反应 | B.加成反应 | C.氧化反应 | D.酯化反应 |
(4)反应③的化学方程式(不用写反应条件,但要配平):
。
(5)在合成线路中,设计第③和⑥这两步反应的目的是:
。
(6分)由以下五种基团一CH3、 、一CHO、一COOH、一OH,
、一CHO、一COOH、一OH,
其中两两结合而形成的化合物,写出所有能与NaOH溶液反应的有机物结构简式。
已知柠檬醛的结构简式为: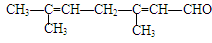
(1)1mol柠檬醛可与mol溴发生加成反应;
(2)柠檬醛完全加氢后,生成物的名称是;
(3)柠檬醛与新制的Cu(OH)2悬浊液反应的化学方程式是
;
(4)若要用实验证明柠檬醛中含有碳碳双键,正确的操作是
已知某有机物的式量是58,根据下列条件回答有关问题:
(1)若该有机物只由碳、氢两种元素组成,写出所有可能的结构简式为、。
(2)若该有机物为含氧衍生物,则分子中有2个—CH3,则结构简式为。
(3)若该含氧衍生物的分子中无—CH3,又无—OH,但能发生银镜反应,则结构简式为。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A、B、C、D、E。
(2)C的同位素名称:C2。
(3)C和D形成分子的电子式为,空间结构为。