(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| C(NH3)/mol·L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,消耗N2的平均反应速率为 ;此条件下该反应的化学平衡常数K= ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向 (填“正反应”或“逆反应”)方向移动。
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:
请写出制备(NH4)2SO4的反应方程式: ;
并利用有关数据简述上述反应能发生的原因
下表是A、B、X、Y、Z五种有机物的有关信息:
| A |
 B B |
X |
Y |
Z |
|||
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:
|
①由C、H两种元素组成; ②球棍模型为:  |
①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与Z反应生成相对分子质量为100的酯。 |
①相对分子质量比X少2; ②能由X氧化而成; |
①由C、H、O三种元素组成; ②球棍模型为:  |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做 ,写出在一定条件下,A生成高分子化合物的化学反应方程式__ _____。
(2) A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=__________时,这类有机物开始出现同分异构体。
(3) B具有下列性质中的哪些? (填号):
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: 。
(4)X与Z反应能生成相对分子质量为100的酯,该反应类型为 ;其化学反应方程式为: 。
(5) 写出由X氧化生成Y的化学反应方程式: 。
为了测定某饱和卤代烃的分子中卤原子的种类和数目,可按下列步骤进行实验: 回答下列问题:
回答下列问题:
(1)准确量取11.40 mL液体所用仪器是________;
(2)加入过量硝酸的作用是___________________________________________;
(3)加入AgNO3溶液时产生的沉淀为浅黄色,则此卤代烃中的卤原子是________;
(4)已知此卤代烃液体的密度是1.65 g/mL,其蒸气对甲烷的相对密度是11.75,则此卤代烃每个分子中卤原子的数目为_______个;此卤代烃的结构简式为:_。
下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素。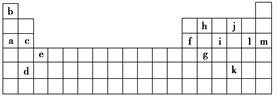
(1)上述第三周期元素中第一电离能(I1)最大的是________(用字母表示,下同),c和f的I1大小关系是________大于________。
(2)上述元素中,原子中未成对电子数最多的是________,写出该元素的电子排布式:________________。
(3)根据下表所提供的电离能数据,回答下列问题。
| 锂 |
X |
Y |
|
| I1 |
519 |
502 |
580 |
| I2 |
7296 |
4570 |
1820 |
| I3 |
11799 |
6920 |
2750 |
| I4 |
9550 |
11600 |
①表中X可能为以上13种元素中的________元素。用元素符号表示X和j形成的化合物的化学式________。
②Y是周期表中的________族的元素。
根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的1/4,外围电子的电子排布图是______。
(2)B是1~36号元素中原子核外电子排布未成对电子数最多的元素,B元素的名称是____,在元素周期表中的位置是____________________。
(3)C元素基态原子的电子排布图是下图中的_______(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______(填编号)。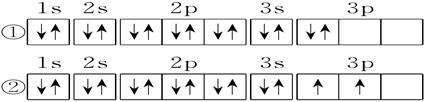
A.能量最低原理B.泡利原理 C.洪特规则
甲醇是一种可再生能源,具有广泛的开发和应用前景。请回答:
(1)工业上合成甲醇CO(g) + 2H2(g) CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。
CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。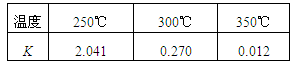
①根据表中数据可判断ΔH(填“>” 或 “=” 或 “<”)0。
②300℃时,向容积为1L的密闭容器中充入2 mol CO、3 mol H2和2 mol CH3OH,此时反应将。
A.向正方向移动B.向逆方向移动C.处于平衡状态
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH= -a kJ·mol-1
②2CO (g)+ O2(g) = 2CO2(g)ΔH= -b kJ·mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
。
(3)改变下列条件,能同时加快正反应的速率,增大CO的转化率的是
A.使用催化剂B.缩小容器体积
C.降低温度D.分离CH3OH的物质的量
(4)以甲醇、氧气为原料,KOH溶液作为电解质溶液构成燃料电池总反应为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,则负极的电极反应式为。