硫的氧化物(SO2和SO3)和大气污染
1)主要来源:煤炭燃烧、火山喷发等。
2)主要危害:产生 。有关的化学方程式是
3)减少污染物的原理和方法:
a.改善燃煤质量。降低煤的含硫量和含灰量。
b.改进燃烧装置和燃烧技术。如向煤中加入石灰石或生石灰,减少产物中SO2的含量,有关的化学方程式是 。
c.发展洁净煤技术。如煤的气化和液化,将焦炭在高温下与水蒸气反应,生成CO和H2;关的化学方程式是 。
d.开发洁净能源
(16分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)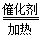 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=__________。
(2)降低温度,该反应K值______,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。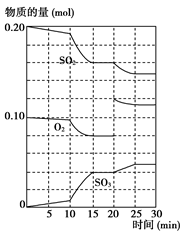
(4)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ __________________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
(12分)如下图所示,在容器A中装有20 ℃的水50 mL,容器B中装有1 mol/L的盐酸50 mL,试管C、D相连通。其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2N2O4 ΔH=-57 kJ/mol;当向A中加入50 g NH4NO3晶体使之溶解;向B中加入2 g苛性钠时: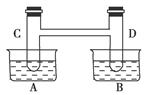
(1)C中的气体颜色______;D中的气体颜色______。
(2)25 ℃时,2NO2N2O4达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=0.032 1 mol/L,则NO2的起始浓度为__________,NO2的转化率为______。
(12分))对于A+2B(气) nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
(15分)工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HOCl→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如下图所示。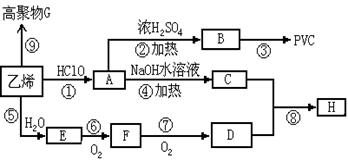
试回答下列问题:
⑴写出有机物B和G的结构简式:B,G;
⑵ ④、⑤的反应类型分别是,;
⑶写出D的同分异构体的结构简式,;
⑷写出反应⑥的化学方程式;
⑸写出C与D按物质的量之比为1︰2反应生成H的化学方程式
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;B在第三周期且化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,位于第四周期第IB族,请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点(填高或低),理由是。
(3)E的最高价氧化物分子的空间构型是。
(4)F的核外电子排布式是,F的高价离子与A的简单氢化物形成的配离子的化学式为.
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为;(黑色球表示F原子)
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为。