向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示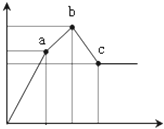
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解。请回答下列问题:
(1)写出b﹣c发生反应的离子方程式: ;
(2)下列说法正确的是
| A.a点的溶质为(NH4)2SO4 |
| B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH﹣) |
| C.b点沉淀为Al(OH)3和BaSO4 |
| D.C点溶液中一定存在:c(AlO2﹣)>c(Ba2+)>c(NH4+) |
(3)写出a﹣b发生反应的离子方程式: ;
(4)滴加到c点共加入Ba(OH)2溶液的体积为 mL,b、a两点沉淀的质量差为 g(精确到0.001).
2008年诺贝尔化学奖授予日本科学家下村修、美国科学家马丁·沙尔菲与美籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量(质量分数约在14%--18%),蛋白质是人体重要营养物质之一,2008年9月“三鹿牌婴幼儿奶粉事件”中,由于在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。三聚氰胺目前由尿素加热分解制得,生产成本价廉,三聚氰胺的结构如图所示。
食品中蛋白质含量的现行国家标准和国际通行测定方法是经典凯氏定氮法,其测定原理是:
Ⅰ.有机物中的氮在强热和CuSO4、浓H2SO4作用下,生成(NH4)2SO4
Ⅱ.(NH4)2SO4与碱作用,蒸馏释放出NH3,收集于H3 BO3溶液中,生成 (NH4)2B4 O7
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,再换算出蛋白质的含量。乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。
(1) 用尿素制备三聚氰胺的化学方程式为: _________________________。
上述原理第Ⅱ步生成(NH4)2B4 O7的离子方程式为:_________________________。
(2)凯氏定氮法在测定奶粉中蛋白质含量时,为什么会失真?
__________________________________________________。
(3)下列关于三聚氰胺的说法中,正确的有_____;
| A.三聚氰胺是一种白色结晶粉末,没有气味,所以掺入奶粉后不易被发现 |
| B.三聚氰胺属于芳香族化合物。 |
| C.三聚氰胺不溶于水,属于分子晶体 |
| D.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐 |
E、三聚氰胺可以发生取代反应
F、三聚氰胺分子中所有原子可能在同一个平面上
G、1mol三聚氰胺可以与3mol氢气发生加成反应
(4)三聚氰胺含氮量(氮元素的质量分数)为____;假定奶粉中蛋白质含量为16%即为合格,三鹿牌婴幼儿配方乳粉抽查结果显示其三聚氰胺含量为2563.00mg/kg,三鹿牌婴幼儿配方乳粉蛋白质含量实际上是____;掺假百分率为____。
在适当的温度和压强下,4体积的某气态化合物完全分解后产生1体积磷蒸气和6体积的氢气,由此可推断该气态化合物的分子式为______,该分解反应的化学方程式为____ 。
非金属元素R的最高价含氧酸的组成为HnROn+2,该酸的分子量是M,R的原子量是______,该酸中R的化合价是______,在R的气态氢化物中R的化合价是______,该氢化物的组成可表示为______。
中学有机化学中同学常碰到关于乙醛和溴反应的问题,对此同学常有如下不同的观点:
①乙醛中醛基有强还原性,而溴单质(Br2)有强氧化性,因而两者可发生氧化还原反应。
②乙醛分子中羰基含有碳氧双键,因而可和Br2发生加成反应。
③乙醛分子中的烃基可和溴发生取代反应。
为此,某同学进行如下实验,并记录了相关实验事实:
实验1:在1mL Br2的CCl4溶液中加入1mL乙醛,发现溶液分层,下层橙黄色,上层无色溶液无明显现象。
实验2:在1mL饱和的溴水中加入1mL乙醛,振荡试管后静置,发现溶液不分层,且发现溴水褪色。
1.根据以上实验1,2及相关实验事实,请你对乙醛和溴的反应原理作出相应的分析:
(1)根据实验1,可推知
(2)根据实验2,可推知
2.目前有一个较为典型的试题是:
“已知柠檬醛的结构简式为(CH3)2C=CHCH2CH2CH=CHCHO,如何检验出其中的C=C双键?”通常的实验方法是:“先加足量的银氨溶液[或新制的Cu(OH)2],取上层清液加酸中和后,然后再用酸性KMnO4溶液(或溴水)检验C=C双键。”
(1)请分析该实验检验方法是否合理,为什么?
(2)根据以上提供的实验事实,是否有更为简便的检验方法?;如果有,请简单说明该实验方法;如果没有,则不必说明。
甲 、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如右图所示。
(1)若R为一种非金属元素,且上述五种物质含有不同的官能团,丁为带水果香味的液体,乙和丁均能在碱性条件下生成甲,戊是一种无色气体,相同条件下相对H2的密度为14,则由甲在一定条件下生成戊的化学方程式为,欲检验乙中官能团,所选用的试剂为(填序号)。
① NaOH溶液 ② Br2的CCl4溶液 ③银氨溶液 ④ AgNO3溶液 ⑤ 稀HNO3
(2)若R为另一种非金属元素,甲与丙为常见大气污染物,且甲与丙的相对分子质量相差16。乙在常温下为气体,丁为空气的主要成分之一。则丁的电子式为,乙的空间构型为;戊的稀溶液能跟过量铁粉反应,其离子方程式为。
(3)若R为一种金属元素,乙由两种元素组成,甲溶液的pH小于7,单质丁在一定条件下可生成戊。甲与戊两种溶液混合生成沉淀丙的离子方程式为,除去镁粉中混有少量的丁,涉及的离子方程式为。