(1)25℃时,①0.1mol·L-1的醋酸 ②0.1mol·L-1的硫酸 ③0.1mol·L-1的氨水的④0.1mol·L-1的NaOH溶液,其pH由小到大的顺序是 (填序号)

(2)下列物质中①NaCl ②BaSO4 ③稀硫酸 ④KOH ⑤H2O ⑥CH3COOH ⑦NH3 ⑧蔗糖 ⑨SO2 ⑩Cu,其中属于强电解质的有 ;其中属于弱电解质的有 ;其中属于非电解质的有 。
(3)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A) pH(B) (填“>”、“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) V(B)(填“>”、“=”或“<”)。
(4)已知:二元酸H2R 的电离方程式是:H2R=H++HR-,HR- R2- + H+,若0.1 mol·L-1NaHR溶液的c(H+)="a" mol·L-1
R2- + H+,若0.1 mol·L-1NaHR溶液的c(H+)="a" mol·L-1 ,则0.1mol·L-1H2R溶液中c(H+) (0.1+a) mol·L-1(填“<”、“>”或“=”),理由是 。
,则0.1mol·L-1H2R溶液中c(H+) (0.1+a) mol·L-1(填“<”、“>”或“=”),理由是 。
(5) 25℃时,若10体积某强碱溶液与1体积的某强酸溶液混合后,溶液的pH=7,则混合前,该强碱溶液的pH(强碱)与强酸溶液pH(强酸)之间应满足的关系是 。
工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式。步骤①中加入足量铁屑的目的是。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。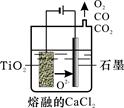
(3)步骤②的离子方程式是,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是。
(5)乳酸可由乙烯经下列步骤合成:
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468kg乳酸亚铁晶体(M=234g/mol)需要标准状况下的乙烯m3。
有机物G是制备液晶材料的中间体之一,其结构简式为: G的一种合成路线如下:
G的一种合成路线如下:
其中,A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:X的核磁共振氢谱只有1种峰;RCH=CH2 RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
RCH2CH2OH;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。请回答下列问题:
(1)A的结构简式是;C中官能团的名称是。
(2)B的名称是。第①~⑦步中属于取代反应的有(填步骤编号)。
(3)写出反应⑤的化学方程式:。
(4)第⑦步反应的化学方程式是。
(5)G经催化氧化得到Y(C11H12O4),写出同时满足下列条件的Y的所有同分异构体的结构简式。
a.苯环上的一氯代物有2种;b.水解生成二元羧酸和醇。
X、Y、Z、D、E、G六种短周期元素的原子序数依次递增。X、Y、D元素的基态原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质和ED2化合物均具有漂白性;R元素的M层全满,N层只有1个电子。
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于______区元素,Y、Z、D三种元素中电负性由小到大的顺序是_________。
(2)X3D+的中心原子杂化轨道类型是__________,该离子的立体构型是。
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是。
(4)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是。
聚碳酸酯无色透明,具有优异的抗冲击性,能用于制造宇航员的面罩、智能手机机身外壳等。双酚化合物是合成聚碳酸酯的单体之一,某种双酚化合物G的合成路线如下: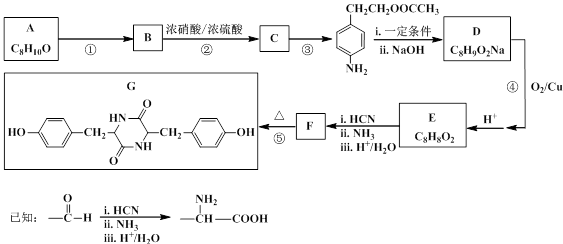
(1)G中所含的官能团除苯环外,还有________________。
(2)写出反应类型。反应 ① ___________;反应 ③ ____________。
(3)写出结构简式。A ______________;F ______________。
(4)写出反应 ④ 的化学方程式_______________________________________。
(5)C有多种同分异构体,写出同时满足下列条件的同分异构体的结构简式_____________。
(I)属于α-氨基酸,且苯环上有三个互为间位的取代基
(II)与FeCl3溶液作用无显色现象
(III)1 mol该同分异构体与足量NaOH溶液反应时,最多能消耗3 mol NaOH
(6)最常见的聚碳酸酯是用双酚A( )与光气(
)与光气( )聚合得到,请写出该聚碳酸酯的结构简式______________________________。
)聚合得到,请写出该聚碳酸酯的结构简式______________________________。
已知:
烃A与氢气以物质的量1:1发生加成反应时可以得到多种产物,以下是其中两种产物的结构简式:
| 产物 |
① |
② |
| 结构简式 |
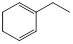 |
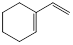 |
(1)除了上述加成产物外,请写出其他加成产物的结构简式:___________(不考虑立体异构)。
(2)鉴别A与其属于芳香烃的同分异构体的试剂是________________(写化学式)。
(3)已知环外双键活泼性高于环内双键,写出产物 ② 发生聚合反应所得产物的结构简式。
_________________。
(4)双烯合成反应过程如下所示:
写出产物 ② 与乙烯发生双烯合成反应产物的结构简式:______________。
(5)以产物 ① 为原料通过三步反应可以转化为2-氯-3-乙基-1,4-环己二醇。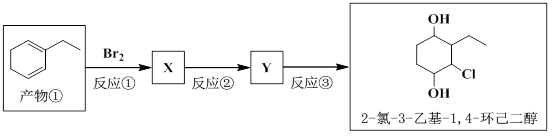
写出反应 ② 的化学方程式。_____________________。