将Na2O2和NaHCO3的混合物粉末分为两等份,其中一份加入100mL盐酸,充分反应后溶液为中性,放出气(已干燥)2.24L(标准状况),将生成的气体全部通入另一份混合粉末,充分反应后气体的体积变为2.016L(标准状况),问:
(1)2.24L气体的成分为: ;
(2)试通过讨论并计算每份混合粉末中Na2O2和NaHCO3的物质的量:
第一种情况:n(Na2O2)= mol和n(NaHCO3)= mol;
第二种情况:n(Na2O2)= mol和n(NaHCO3)= mol.
燃煤废气、汽车尾气中的氮氧化物(NOx)、一氧化碳等有害气体,常用下列方法处理,以减少对环境的污染。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1
则1molCH4将NO2还原为N2的反应热为;
(2)除氮氧化物及CO外,汽车尾气中 还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧
还含有碳氢化合物等污染物,下图是汽车尾气转化研究的示意图:表示的是Pt/Al2O3/Ba表面吸附与解吸作用的机理,氮氧 化物是NO2,碳氢化合物是CxHy
化物是NO2,碳氢化合物是CxHy ,写出两者反应的化学方程式:,Pt/Al2O3/Ba的作用是;
,写出两者反应的化学方程式:,Pt/Al2O3/Ba的作用是;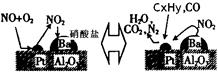
(3)平衡常数K的数值大小,是衡量化学反应进行程度的标志,K的数值越大,化学反应的限度越大,反应物反应的越充分。在25℃时,下列反应的平衡常数如下:
N2(g)+O2(g)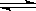 2NO(g)K1=1×10-30㈠
2NO(g)K1=1×10-30㈠
2H2(g)+O2(g)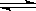 2H2O(g) K2=2×1081㈡
2H2O(g) K2=2×1081㈡
2CO2 (g)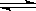 2CO(g)+O2(g)K3=4×10-92㈢
2CO(g)+O2(g)K3=4×10-92㈢ ①常温下,反应2H2O(g) 2H2(g)
①常温下,反应2H2O(g) 2H2(g) +O2(g) 平衡常数K=;
+O2(g) 平衡常数K=;
②关于以上反应,下列说法正确的是
A. 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 常温下,NO,H2O,CO2三种化合物分解放出氧气的倾向大小顺序:NO>H2O>CO2 |
| B.若升高温度,反应㈢的平衡常数K3将增大 |
| C.若只增加压强,且反应物、生成物状态不变,反应㈠平衡不发生移动,平衡常数不变;反应㈡平衡朝正向移动,平衡常数增大 |
| D.若增加汽车发动机空气的进气量,可同时减少氮氧化物和一氧化碳的排放 |
③基于环保法规,要求改装汽车尾气处理装置,达到使氮氧化物(NO)、一氧化碳转化为无污染、可排放的气体的目的。改装的方法主要是加入有效催化剂,请你根据以上有关数据分析,在不改变其它条件的情况下,可使用催化剂除污染气体的原因:。
天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C ="=" K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式:;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢 加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
;
实验 二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,
二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量, 一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:;
一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:;
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏 二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为;
二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该 物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子
物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子 方程式:;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱
方程式:;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱 反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:。
反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:。
在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化.
(1)先出现红褐色沉淀,原因是__________________________________.
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式____________________________.
(3)最后溶液颜色加深,此原因的反应 的离子方程式是________________________
的离子方程式是________________________
(10分)(1)已知下列变化过程中,0.2 mol R2O72-与0.2 mol K2SO3恰好反应,则R被还原的价态为____。
(2)在100 mL 0.100 mol·L-1的FeBr2溶液中通入Cl2,若要使Fe2+刚好反应完全,则需标准状况下C l2________ mL。
l2________ mL。
(3)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
①已知KBrO3在反应中得到电子,则该反应的还原剂是______________________.
②已知0.2 mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
mol KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
10.4gR2SO4中含0. 1molR2+,则R2SO4的摩尔质量是;R的相对原子质量是。