在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化.
(1)先出现红褐色沉淀,原因是__________________________________.
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式____________________________.
(3)最后溶液颜色加深,此原因的反应 的离子方程式是________________________
的离子方程式是________________________
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号。由X和Y元素组成的14电子分子的电子式为。
(2)在水溶液中 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+, +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为。
A~M均为有机物,有如图所示转化关系。A的分子式为C9H9O2Cl,其苯环上只有两个取代基,A与F均能与 NaHCO3溶液反应,F的分子式为C9H10O2;D不能发生银镜反应;M与足量NaOH溶液反应后的有机产物,其一氯代物只有一种。
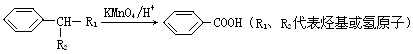
请回答: (1)A分子中所含官能团名称是。
(2)反应①~⑦中,属于消去反应的是________ (填反应序号)。
(3) D、M的结构简式分别为____________、____________。
(4) 反应①的化学方程式为________________________。
反应⑦的化学方程式为________________________。
(5)同时符合下列条件的F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关回答均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_______。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________。
(3)X与Z中电负性较大的是__________;Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是_____,此离子中含有的化学键类型是____;X一Z一X的键角_____109. 50。(填“>”、“=”或“<”)
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以相距一个X离子最近的所有Y离子为顶点构成的几何体为。该化合物与MgO相比,熔点较高的是_____。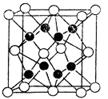
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为____g/cm3。(列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):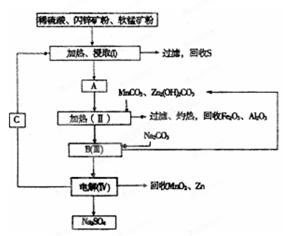
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解方程式为
(1)A中属于还原产物的是_____。
(2)加人MnCO3、Zn2(OH)2CO3的作用是_________________;II需要加热的原因是:______;C的化学式是_________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_____。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是_______。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进 行的操作有蒸发浓缩、 、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____。
氮及其化合物与人类各方面有着密切的联系。Ⅰ现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为mL。
Ⅱ目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H="-574kJ/mol"
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H="-1160kJ/mol"
③H2O(g)= H2O(l)△H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式。
(2)用活性炭还原法处理氮氧化物,有关反应为:
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下: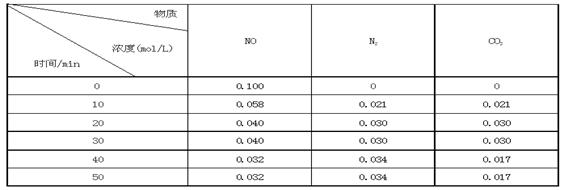
①不能作为判断反应达到化学平衡状态的依据是_______;(选填字母代号)
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)=。v(NO)=(0.1- 0.04)/ 20 = 0.003mol·L-1· min-1
③在T0C时,该反应的平衡常数为_______(保留两位小数);
④在30min,改变某一条件反应重新达到平衡,则改变的条件是_______。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为: 
研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
| 实验编号 |
T(0C) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比 表面积(m2/g) |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
a |
b |
c |
124 |
| Ⅲ |
350 |
d |
e |
124 |
上表中:a=_______,b=________,e=________。