有机化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余含有氧;现代仪器分析有机化合物的分子结构有以下三种方法。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3。
方法三:利用红外光谱仪测得A分子的红外光谱如下图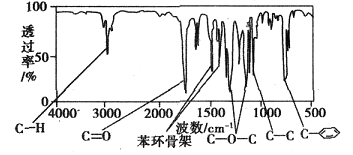
试填空:
(1)A的分子式为____________________。
(2)A的结构简式为____________________(合理即可)。
(3)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基。则该类A的芳香类同分异构体还有__________种。
(4)A的一种同分异构体E可用作茉莉、白兰、月下香等香精的调合香料。它可以用甲苯和乙醇为原料进行人工合成。合成路线如下: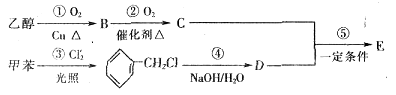
①E的结构简式为______________________________。
②反应②③的反应类型为____________________,____________________。
③写出反应①的化学方程式________________________________________。
④为了提高E的产率应采取的措施是____________________(写一项)。
(10分) 对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有 HCO3-、Cl-等离子中的若干种。然后又作了如下的实验分析:
HCO3-、Cl-等离子中的若干种。然后又作了如下的实验分析:
①用石蕊试液检测该溶液时,溶液显红色。
②用铂丝蘸取溶液在无色火焰上灼烧,透过蓝色的钴玻璃片观察火焰呈紫色。
③取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
④对③中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是_________________,一定不存在的离子是 ____________。
____________。
(2)通过上述实验操作,不能肯定在原溶液中是否存在的离子是____________________。
(3)在上述实验操作中,有错误的步骤是(填步骤序号)________。对该错误改正的方法是(作出简答)______________________________________________________________。
(13分) 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(已知:2Al + 3FeO 3Fe + Al2O3;2
3Fe + Al2O3;2 Al + Fe2O3
Al + Fe2O3 2Fe + Al2O3;
2Fe + Al2O3;
8Al + 3Fe3O4 9Fe + 4Al2O3)
9Fe + 4Al2O3)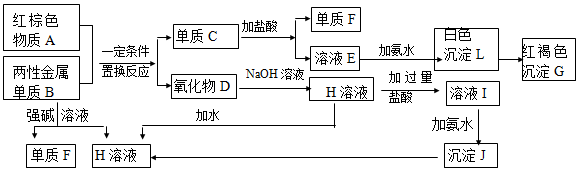
(1)化合物A的化学式是,写出物质A的一种用途。
(2)写出单质B与强碱溶液反应的离子方程式。
(3)写出由沉淀J生成 H溶液的离子方程式 。
。
(4)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式。
白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(5)溶液I中所含金属离子是_____________________。
(17分) 现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4⑥Ba(OH)2
⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程 式为__________________________________________________________。
式为__________________________________________________________。
(3)⑩在水中的电离方程式为__________________________________________________,
(4)少量的④通入⑥的溶液中反应的离子方程式为________________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是_____________,当有5.4g Al发生反应时,转移电子的物质的量为_________________。该反应的离子方程式为___________________________________________________。
(10分) 按要求填空
(1)配平下列化学方程式:并用单线桥标出电子转移的方向和数目。
______Fe3O4 + ______CO = _____Fe+_______CO2
(2)检验SO42-所需要用的试剂__________________和___ _______________。
_______________。
(3)三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(4)0.3 mol NH3分子中所含质子数与________个H2O分子中所含质子数相等。
研究NO2、SO2 、等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L 。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L 。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =" -" 113.0 kJ· mol-1
2NO2(g) ΔH =" -" 113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH =kJ· mol-1。
SO3(g)+NO(g)的ΔH =kJ· mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。