(13分) 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(已知:2Al + 3FeO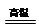 3Fe + Al2O3;2
3Fe + Al2O3;2 Al + Fe2O3
Al + Fe2O3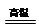 2Fe + Al2O3;
2Fe + Al2O3;
8Al + 3Fe3O4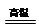 9Fe + 4Al2O3)
9Fe + 4Al2O3)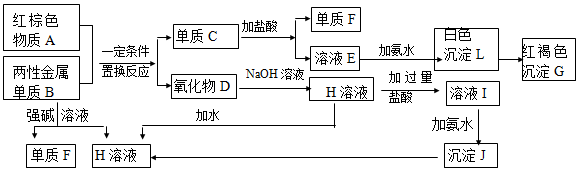
(1)化合物A的化学式是 ,写出物质A的一种用途 。
(2)写出单质B与强碱溶液反应的离子方程式 。
(3)写出由沉淀J生成 H溶液的离子方程式  。
。
(4)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式 。
白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式 。
(5)溶液I中所含金属离子是_____________________。
(11分)下表是元素周期表的一部分,请从有标注的11种元素中选择合适的元素按要求回答下列问题:
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||||
| 1 |
① |
|||||||||||||
| 2 |
② |
③ |
④ |
|||||||||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||||||||
| 4 |
⑩ |
⑾ |
(1)化学性质最不活泼的元素的原子结构示意图为 。
(2)用元素符号填写:除⑨外原子半径最大的元素是 ______,原子半径最小的元素是_____,非金属性最强的元素是_____,金属性最强的元素是_____。
(3)①与④形成化合物的化学键类型是_________ (填 “极性键”、“非极性键”或“离子键”),①与⑦形成的化合物的电子式为 。
(4)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该两性氢氧化物与⑧的氢化物的水溶液反应的离子方程式 。
(5)⑤⑥两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (双选题,漏选得1分,多选错选得0分)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)HX +  (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被菌素原子取代。
工业上利用上述信息,按下列路线合成结构简式为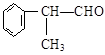 的物质,该物质是一种香料。
的物质,该物质是一种香料。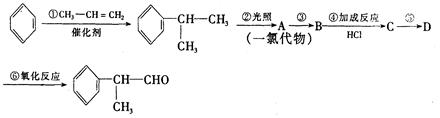
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
已知:①卤代烃在一定条件下能水解,如 (R为烃基,X表示卤原子)②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:
(R为烃基,X表示卤原子)②有机物中的硝基在铁和盐酸作用下,能被还原成氨基:对乙酰胺基酚又名扑热息痛,为白色晶体,是一种优良的解热镇痛药,其毒性较菲那西汀、阿司匹林低。扑热息痛的生产流程为:

请回答下列问题:
(1)写出反应的化学方程式
由氯苯制A:________________
由A制B:__________________
由B制C:__________________
(2)扑热息痛在潮湿环境中长期受热发生水解,写出扑热息痛水解的化学方程式。
某有机物A的结构简式为:
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是。
(2)A与新制Cu(OH)2反应时,A与被还原的Cu(OH)2的物质的量之比是。1molA最多能消耗mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是。
已知:①R—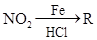 —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图: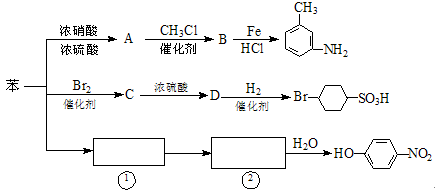
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有种同分异构体。
(4)有机物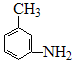 的所有原子(填“是”或“不是”)在同一平面上。
的所有原子(填“是”或“不是”)在同一平面上。