已知:
2H2(气)+O2(气)=2H2O(气)+Q1 2H2(气)+O2(气)=2H2O(液)+Q2
2CO(气)+O2(气)=2CO2(气)+Q3
(1)关于Q1和Q2的关系正确的是______。
| A.Q1>Q2 | B.Q1<Q2 |
| C.Q1=Q2 | D.无法比较 |
你选择该答案的理由是______。
(2)CO和H2分别燃烧生成CO2和H2O(气),欲得到相同的热量,所需CO和H2的体积比是______。
A为药用有机物,从A出发可发生如图所示的一系列反应。已知A在一定条件下能与醇发生酯化反应,A分子中苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应。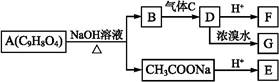
请回答下列问题:
(1)F中的含氧官能团的名称为 。
(2)F能发生的反应类型有 (填序号)。
①取代反应 ②加成反应 ③消去反应 ④加聚反应 ⑤缩聚反应
(3)C的化学式为 ,G的结构简式为 。
(4)某有机物X符合下列条件要求,其名称为 。
①与E的摩尔质量相同
②不与碳酸氢钠溶液反应,但与金属钠反应有气泡生成
③链状结构且核磁共振氢谱有三组峰
(5)芳香族化合物M与A是同分异构体,苯环上两个取代基在对位;M与A具有相同的官能团。但与新制氢氧化铜悬浊液共热有砖红色沉淀生成,其中一种符合条件的M与NaOH溶液反应的化学方程式为 。
已知:
Ⅰ.A是石油裂解气的主要成分之一。
Ⅱ.H为苯的同系物;在相同的条件下,其气体对H2的相对密度为46;其核磁共振氢谱有4个峰,峰面积之比为1∶2∶2∶3。
Ⅲ. +CH3Br
+CH3Br
 +HBr
+HBr
Ⅳ.C物质苯环上的一卤代物只有两种。
有机物A存在下列转化关系:
回答下列问题:
(1)B的名称是 。
(2)D的结构简式是 。
(3)反应⑥的反应类型是 。
(4)写出反应⑤的化学方程式 。
(5)分子中具有苯环,苯环上有两个取代基,且能与NaHCO3溶液反应的E的同分异构体有 种(不包含E),写出其中一种同分异构体的结构简式 。
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。DBP是增塑剂的一种,可由下列路线合成。
已知以下信息:
①R1CHO+R2CH2CHO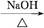
 +H2O
+H2O
②

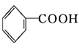
(—R1、—R2表示氢原子或烃基)
(1)A的结构简式为 ,D→E的反应类型为 。
(2)B的名称是 ,D中含有的官能团名称是 。
(3)由B和E合成DBP的化学方程式为 。
(4)写出同时符合下列条件的B的所有同分异构体结构简式 。
①能与NaHCO3溶液反应生成CO2 ②能发生银镜反应 ③能使FeCl3溶液发生显色反应 ④苯环上含碳基团处于对位
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 |
C—C |
C—N |
C—S |
| 键能/(kJ·mol-1) |
347 |
305 |
259 |
(2)C 、—CH3(甲基)、C
、—CH3(甲基)、C 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.C 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.C 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个C 和一个C
和一个C 结合均可得到CH3CH3
结合均可得到CH3CH3
(3)金属阳离子含未成对电子越多,则磁性越强,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键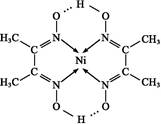
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为 (填元素符号),其原因为 。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为 ;1 mol B2A4分子中含 mol σ键。
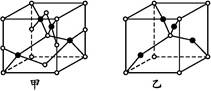
(4)已知D、E能形成晶胞如下图所示的两种化合物,化合物的化学式,甲为 ,乙为 ;高温时,甲易转化为乙的原因为 。