有铜片、锌片、若干小烧杯、导线、、盐桥(含琼胶的KCl饱和溶液)、电流计、ZnSO4溶液、CuSO4溶液,试画出原电池的装置图,并说明其工作原理。
⑴原电池装置图; ⑵工作原理;
下图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是有特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。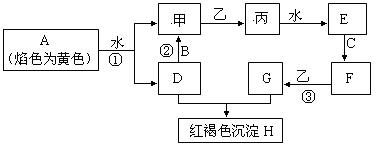
请根据以上信息回答下列问题:
(1)写出:H的化学式_________,乙的两种重要用途________________________________
(2)写出有关反应的离子方程式:
反应①__________________________________________________________
反应②__________________________________________________________
(3)判断反应③己经发生的常用试剂是______________________
(4)胶态磁流体(液溶胶)在医学上有重要用途,C单质对应元素的某种纳米级氧化物是磁流体中的重要粒子,该磁流体的主要制备过程如下:(Ⅰ)将NH3通入F、G的混合溶液(F、G物质的量比为1:2)中会生成两种碱。(Ⅱ)这两种碱恰好反应就得到该氧化物。写出(Ⅱ)中反应的化学方程式为:_________________________,确定该磁流体己成功制取的方法_________________________________
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40—50℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体:Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作(填氧化剂或还原剂)。
(2)写出CuH在氯气中燃烧的化学反应方程式
(3)CuH溶解在稀盐酸中生成的气体是(填化学式)
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)用方程式表示工业上用石灰石、氯气为原料生产漂白粉的原理_________________
_______________________________________________________,漂白粉的有效成分是(填化学式)
(2)漂白粉可用于饮用水或环境消毒,它溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,写出相应的化学方程式:___________________
(3)浓盐酸和次氯酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,该反应中转移的电子数为___________
| A.①②③ | B.②③④ | C.②③ | D.①④ |
已知气体X2和气体Y2在一定条件下能化合生成气体C,并知C的化学式只有三种可能:XY、X2Y、X3Y。为确定C的化学,某同学分别取同温同压下,体积都为V1的X2和Y2两种气体充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原温后,再测出容器的容积(V2)。请填写下列结论与分析
(1)若实验结果(用V1、V2间关系来表示)是___________,则生成物C的化学式为XY,判断的依据是_____________________________________________________
(2)当生成物C的化学式为X2Y时,则实验结果是_____________,生成C的化学方程式为____________
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式。
(2)现用1kg这种废铜屑理论上能制取胆矾多少千克?
(3)①将胆矾与生石灰、水按质量比依次为1:0.56:100混合配成无机铜杀菌剂波尔多液。
此波尔多液中Cu2+和Ca2+离子的物质的量比为______(最简整数比)
②波尔多液有效成分的化学式可表示为CuSO4 •xCu(OH)2 •yCa(OH)2,此种配比当x=1时,试确定y的数值。