将FeCl3溶液与NH4SCN溶液混合发生如下反应
①Fe3++SCN- Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2
红色 深红色
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001 mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4 mol/L,c[Fe(SCN)2+]约为1.5×10-4 mol/L,c[Fe(SCN)2+]约为5×10-6 mol/L,则反应②的平衡常数K2为 。
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是 。仔细观察,滴加NH4SCN溶液时,混合液颜色更深一些,其原因是 。
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式 ,继续滴加H2O2,溶液褪色,产生大量能够使澄清石灰水变浑浊的气体且硫氰根中氮元素全部转化为N2,向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成。写出H2O2与SCN-反应的离子方程式 。
(4)为测定某溶液中c(Cl-),取待测液V1 mL,向其中加入V2 mL浓度为c2 mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2·12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3 mL。(已知Ag++SCN- = AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(Ag Cl)=1.56×10-10)。请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将 。(填“偏高”,“偏低”或不变)。
②最终测得c(Cl-)= mol/L。
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C 、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)。
、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)。
(2)A、B、C形成的化合物的晶体类型为,电子式为。
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式。
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式。
(5)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的热化学方程式。
(6)含有元素C的盐的焰色反应为________色.许多金属盐都可以发生焰色反应,其原因是_______________________ ________________________________.
________________________________.
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有种。
(2)请写出Cr元素的核外电子排布式。
(3)某元素的正三价离子的3d能级为半充满,该元素的元素名称为,其单质在一定条件下能与S反应,试写出该反应的化学方程式。
(4)某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布图为。
(11分) (1)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
| 项目 |
熔点/℃ |
硬度 |
水溶性 |
导电性 |
水溶液与Ag+反应 |
| A |
811 |
较大 |
易溶 |
水溶液(或熔融)导电 |
白色沉淀 |
| B |
3 500 |
很大 |
不溶 |
不导电 |
不反应 |
| C |
-114.2 |
很小 |
易溶 |
液态不导电 |
白色沉淀 |
① 晶体的化学式及晶体类型分别为:
A____________;B__________;C____ ____。
② 晶体中粒子间的作用分别为:
A_________;B________;C________。
(2)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
①写出与H2O分子互为等电子体的微粒__________(填一种即可)。
②水分子在特定条件下容易得到一个H+,形成水合氢离 子(H3O+)。下列对上述过程的描述不合理的是()
子(H3O+)。下列对上述过程的描述不合理的是()
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
③下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)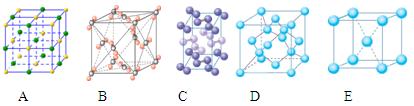
在下列物质中:①K2SO4②H2O2 ③(NH4)2S ④Na2O2 ⑤C2H2 ⑥SiC
⑦Na2S⑧单晶硅⑨Cu。(填序号)其中含有极性共价键的原子晶体是;其中既含有离子键又含有共价键的离子晶体是;其中含有极性共价键和非极性共价键的非极性分子是;直接由原子构成的晶体是;受热融化后化学键不发生变化的是。
(12分) 短周期的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素最外电子层上的电子数的和;Y元素原子最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)X元素的名称是___ __;Y元素的名称是______;Z元素的名称是___ ____;
(2)XZ3化合物的化学式是______ _______,Y元素所形成的最高价氧化物的电子式是___ ____;
(3) X、Y的最高价氧化物的水化物的酸性强弱:__________(用化学式表示);
⑷将铜片投放到X的最高价氧化物的水化物的稀溶液中,观察到铜片上有气泡产生,写出该反应的离子方程式:。