(14分)Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是 。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为 。
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目: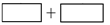
(4)若反应中浓H2SO4过量,则  产物中无X生成,请完成此化学反应方程式: 。
产物中无X生成,请完成此化学反应方程式: 。
Ⅱ .短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):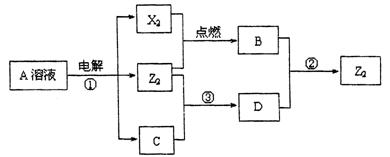
(1)Y在周期表的位置是 ;
(2)反应①的化学方程式是 
 。
。
(3)D溶液呈碱性的原因是(用离子方 程式表示) 。
程式表示) 。
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。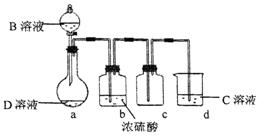
(4)写出反应②的离子方程式 。
(5)上述实验装置不够完善,改进方法是 。
在①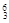 Li 、②
Li 、②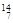 N 、③
N 、③ Na 、④
Na 、④ Mg 、⑤
Mg 、⑤ Li 、⑥
Li 、⑥ C 、⑦C60 、⑧石墨中,选择序号填空。
C 、⑦C60 、⑧石墨中,选择序号填空。
(1)和质量数相等,但不能互称同位素;
(2)和的中子数相等,但质子数不相等,所以不是同一种元素;
(3)和互为同素异形体。
工业上用铬铁矿(主要成分FeO·Cr2O3,杂质为SiO2、Al2O3等)
生产重铬酸钾(化学式K2Cr2O7,)的流程如下: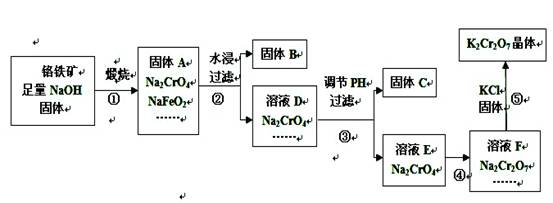
(1)固体A中,除Na2CrO4、NaFeO2、NaOH外还有等;
(2)固体A水浸时,NaFeO2会发生强烈水解产生固体B,其化学反应方程
式为;
(3)固体C中含有2种物质,要先加入下列物质中的,然后才
能进行过滤分离。
A.氢氧化钠溶液B.稀氨水C.稀盐酸
(4)步骤④加入盐酸得到的溶液F中,除Na2 Cr2O7外,还含有的溶质
是;
(5)在上述流程中,有氧化还原反应发生的是第____步。
(6)已知20℃时K2Cr2O7饱和溶液浓度为0.4 mol·L-1,步骤⑤中加入固
体氯化钾,若使K+离子浓度达到4 mol·L-1(保持温度20℃),则溶液F中Cr2O72-离子的浓度最大为。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2-3次。
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_____ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用__________________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果______(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_________________________________;判断到达滴定终点的依据是:______________________________________________________________。
(4)以下是实验数据记录表
| 滴定次数 |
盐酸体积(mL) |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.04 |
| 3 |
20.00 |
0.20 |
16.28 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,
其可能的原因是( )
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视计数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为: ________mol·L-1
.(12分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产
生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性;常温下,0.1 mol/L
B溶液的pH大于13,0.1 mol/L C溶液的pH等于1
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有
气体产生;(沉淀包括难溶物和微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)写出A、B、C、D、E的化学式:A、B、
C、D、E
(2)写出A、E溶液反应的离子方程式:
。
(3)写出B溶液与C溶液恰好完全反应的离子方程式:
_____。
(4)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由小到大的顺序为(带两个单位电荷的离子不参与比较):__________________________________。
(12分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素的原子结构示意图为__________,该元素的符号是__________;
(2)Y元素原子的的价电子排布式为_______________________________,该元素的名称是__________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性
由高到低_____________________________________。