食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是 ▲ 。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol•L-1,则该食醋的总酸量为4.5/100mL
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法 验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 ▲ (填写序号)。
验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 ▲ (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1HCl溶液和20.00mL0.1000 mol•L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。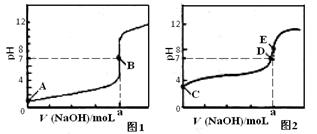
滴定醋酸溶液的曲线是 ▲ (填“图l”或“图2”);滴定曲线中a= ▲ mL。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是 ▲ 。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(14分)合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为。
②图B中T=450℃,则温度为500℃时对应的曲线是(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)=。
②该温度下,上述反应的平衡常数K=。
③反应在7~10 min内,CO的物质的量减少的原因可能是(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
(12分)下图中,A到L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕色烟,B、G为中学化学中常见金属单质,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味气体,且能使品红溶液褪色。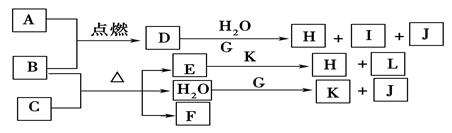
回答下列问题:
(1)K所含的化学键有。
(2)D的水溶液与G反应的总离子方程式为_______________________________________________。
(3)写出工业上制取单质G的化学方程式。
(4)将气体F通入下列装置中
写出A、B中的离子方程式:
、。
(5)若将F通入一定量K的水溶液中,则所得溶液中各离子浓度一定满足的关系式为
。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g )△H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g )△H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程: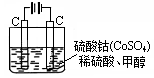
①写出阳极电极反应式。
②写出除去甲醇的离子方程式。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极反应式
负极。
有A、B、C、D、E五种短周期主族元素,A、B、C、D原子序数依次增大,原子半径按D、A、B、C、E依次减小,A、B的核电荷数之和等于D的核电荷数,D的最外层电子数为C的最外层电子数的一半,E可以分别与A、B、C形成电子总数相同的共价分子。
⑴写出元素D在周期表中的位置。
⑵元素A的非金属(填“>”或“<”)元素C
⑶C离子与D离子的电子数相等,比较这两种离子的半径大小:C离子(填“>”或“<”)D离子
⑷写出由元素A和元素E组成的10电子分子的电子式。
⑸氧化铜与D的单质在高温下发生化学反应的方程式
,若得到1mol氧化产物,则该反应转移电子mol。取该反应的还原产物3.2g与12.5mL、8mol/L的硫酸溶液(98%的硫酸其物质的量的浓度为18mol/L)混合,按右图装置进行实验,实验发现,3.2g还原产物几乎被消耗掉,请你解释其原因。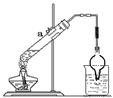
选择下列物质分离和检验方法,将其序号填在横线上。
| A.萃取 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
(1)______分离饱和食盐水与沙子的混合物。
(2)______从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)______分离水和汽油的混合物。
(4)______分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体。