甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是  ;
;
②丙溶液中通入少量CO2生成丁的离子方程式是 。
(2)若2乙(g) + 甲(g)  2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
| 温度/℃ |
400 |
450 |
500 |
550 |
600 |
650 |
| 转化率/% |
99.2 |
97.5 |
93.5 |
85.6 |
73.7 |
58.5 |
①该反应的△H 0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是 ;
②已知:R(s) +  O2(g) =
O2(g) =  R2O3(s) △H=-834.8 kJ·mol-1
R2O3(s) △H=-834.8 kJ·mol-1
Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol-1
写出R的单质与MnO2反应的热化学方程式 。
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;
请完成下列填空:
(1)H的化学式、F的电子式。
(2)F和CO2的化学方程式。写出G溶液中逐滴加入等物质的量的I溶液反应的离子方程式。
(3)A与B 在加热条件下反应的主要现象是;检验H 中阳离子的方法是。
下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:
族 周期 周期 |
0 |
|||||||
| 1 |
IA |
ⅡA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
③ |
④ |
||||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
⑴⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
⑵比较④⑨的氢化物沸点高低顺序并说明理由____________________________。
⑶ lg单质①在常温下完全燃烧生成气态产物放出Q kJ的热量,请写出其表示燃烧的热化学方程式_________________________________________。
⑷由表中两种元素组成的电子数与⑨相同的化合物的化学式为________________。
⑸由⑦⑩两种元素组成的一种化合物,其水溶液呈_________性(填“酸”、“碱”或“中”),其原因_____________________(用离子方程式表达)。
⑹由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式__________________________________。
甲、乙、丙三种物质之间有如下转化关系:
(1)若甲是不溶于水的白色固体氧化物,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是________(填化学式);写出 乙→丙转化的离子方程式:_______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________(填化学式);
写出甲→乙转化的离子方程式_________________________________________。
现有NaCl、Na2O2、NaHCO3和Na2SiO3等多种重要的化合物。请用化学式填空:
(1)常作为潜水艇和呼吸面具中氧气来源的淡黄色固体是,所发生主要反应的化学反应方程式为;
(2)常用于焙制糕点,也可用作抗酸药的是 ;
(3)用于制备硅胶和木材防火剂的是。
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g)  2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 (填字母序号)。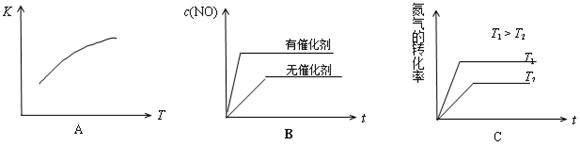
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数(填“变大、“变小”或“不变)