选做【化学——化学与技术】工业上提炼TiO2的工艺流程如下:
(1)写出硫酸溶解钛铁精矿(FeTiO3)生成TiO2+的离子方程式 。
(2)副产物A的主要成分为 。
(3)滤液水解时往往需加大量水稀释同时加热,其目的是 。
(4)上述工艺流程中体现绿色化学理念的是 。
(5)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti的化学方程式: 、 。
配制500ml,0.200mol·L-1KCl溶液,需要KCl的质量为 g。
9.8gH2SO4的物质的量是 ;
2.0molH2O的质量是 。
(1)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:2NO2(g)⇌N2O4(g)当活塞迅速向里推时,气体的颜色先 ,后 (填“变深”“变浅”或“不变”前同);最终和最初相比,颜色 更深(填“最初”或“最终”下同),气体的平均相对分子质量 更大.
(2)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
①x= ,②B的转化率为 .
③温度降低,K值增大,则正反应是 (填“放热”或“吸热”)反应.
④能判断该反应达到平衡状态的依据是 (填编号)
A、混合气体的密度不变
B、容器中的压强不再变化
C、生成D的反应速率是生成B的反应速率的2倍
D、单位时间内生成3molA,同时生成1molB
⑤在其他条件不变的情况下,将原容器体积扩大到4L,下列有关该体系的说法正确的是()(填编号)
A、B的浓度减少
B、正反应速率加快,逆反应速率也加快
C、C的物质的量增加
D、重新平衡时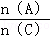 增大.
增大.
今有①CH3COOH、②HCl、③H2SO4三种溶液,请用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列的是 .
(2)当它们的物质的量浓度相同时,其pH由大到小排列的是 .
(3)中和等量的烧碱溶液,需同浓度的三种酸溶液的体积大小关系为 .
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,所需烧碱溶液的体积由大到小关系为 .
在氢氟酸溶液中,存在如下电离平衡:HF H++F﹣
H++F﹣
(1)加入固体NaOH,电离平衡向 反应方向移动,c(H+) .
(2)加入固体NaF,电离平衡向 反应方向移动,c(H+) .
(3)升高温度,电离平衡向 反应方向移动,c(H+) .