工业上合成甲醇一般采用下列反应: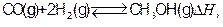 下表是该反应在不同温度下的化学平衡常数(K):
下表是该反应在不同温度下的化学平衡常数(K):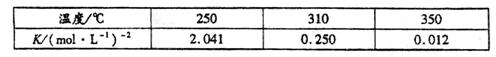
(1)由表中数据判断 0(填“>”、“=”或“<”)。
0(填“>”、“=”或“<”)。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol·L-1,则此时的温度为 ℃。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表: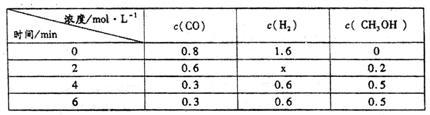
①反应从2min到4min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2min时改变了反应条件,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压 下:
下:
①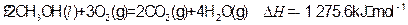
②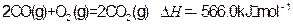
③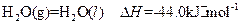
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳。该电池的负极反应式为: 。
若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为 L。
某学生在实验室测定溶液的pH时,先将pH试纸用蒸馏水润湿后再进行测定,其测定结果是否一定有误差?_____________,理由是_______________________________________。若用此方法分别测定c(H+)相等的H2SO4和H3PO4的pH,误差较大的是_____________,理由是_______________________________________。
如图4-6所示,甲是刚浸过Na2SO4溶液的滤纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现A、B间紫红色圆点向A移动了一段距离,则与A相连的是电源的 极,可发现滤纸的 极边沿附近有 色出现。
某地的酸雨中,含c(Na+)=7.0×10-6 mol·L-1,c(Cl-)=4.5×10-5 mol·L-1,c(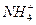 )=2.3×10-5 mol·L-1,c(
)=2.3×10-5 mol·L-1,c(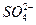 )=2.5×10-6 mol·L-1,则该地酸雨的pH约为。
)=2.5×10-6 mol·L-1,则该地酸雨的pH约为。
设水的电离平衡线如图3-4所示:(1)若以A点表示20 ℃时水在电离平衡时的离子浓度,当温度上升到100 ℃时,水的电离平衡状态到B点。则此时水的离子积______从增大到______。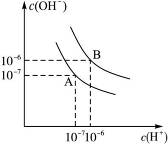
图3-4
(2)将100 ℃时pH=8的Ba(OH)2溶液与pH=5的稀H2SO4混合,并保持100 ℃的恒温。欲使混合液的pH=7,则Ba(OH)2与稀H2SO4的体积比为(二者混合后体积假设为二者体积之和)。
常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合造成的体积变化忽略不计,计算结果保留小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入 mL。
(2)若用pH=2的盐酸,应加入mL。
(3)若用0.01 mol·L-1的CH3COOH溶液V1 mL,则V1的取值范围为__________。
(4)若用pH=2的任意一元弱酸HR溶液V2 mL,则V2的取值范围为_________。