在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于溶液的时间/s |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
细小颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1= s
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1 t4(填“>”或“<”),原因是
t2 t3(填“>”或“<”),原因是
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
(7分)常温下,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L的混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示
,,。
(2)该溶液中,浓度为0.01 mol/L的粒子是,浓度为0.002 mol/L的粒子是。
(3)和两种粒子物质的量之和等于0.01 mol。
(7分)(1)用系统命名法给下列物质命名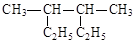 名称:
名称: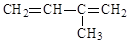 名称:
名称:
(2)分子式为C5H10的烯烃的结构有种,其中有三个—CH3的结构简式为:。 一氯丁烯的同分异构体有8种,分子里含有
一氯丁烯的同分异构体有8种,分子里含有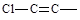 结构的有种
结构的有种
在恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) C(g)+D(g),所得实验数据如下表:
C(g)+D(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
||
| n(A) |
n(B) |
n(D) |
|||
| ① |
700 |
0.40 |
0.10 |
0.090 |
|
| ② |
800 |
0.10 |
0.40 |
0.080 |
|
| ③ |
800 |
0.20 |
0.30 |
a |
|
| ④ |
900 |
0.10 |
0.15 |
b |
请回答下列问题
(1)表中 2(选填“>”、“=”或“<”)
2(选填“>”、“=”或“<”)
(2)800℃时,若起始时向该容器中充入0.5molA(g)、1.0molB(g)、0.3molC(g)、1.8molD(g),则反应开始时的反应速率 v (正)v (逆) (选填“>”、“=”或“<”)。
(3)实验③中,达到平衡时X的转化率为多少?(写出解题过程)
(8分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
请回答下列问题:
(1)研磨孔雀石的目的是。
(2)加入双氧水的目的是将溶液中的Fe2+转化为Fe3+,相应的离子方程式为。
(3)固体c中主要成分的化学式为。加入氧化铜的作用是。
A、B、C、D分别是(NH4)2SO4、Ba(OH)2、AlCl3、Na2CO3四种物质中的某一种,现进行如下实验:
①实验测得A溶液和D溶液显碱性,B溶液和C溶液显酸性;
②A溶液和D溶液混合可生成沉淀甲
③足量A溶液与B溶液混合共热可生成沉淀乙和刺激性气味气体;
请回答下列问题:
(1)A的化学式为________,D的化学式为________。
(2)将C溶液加热蒸干,并灼烧至恒重,最后所得固体为________(填化学式)。
(3)B溶液中离子浓度由大到小的顺序为。
(4)将沉淀甲加入到B溶液中,沉淀甲会转化为沉淀乙。沉淀甲能转化为沉淀乙的原因是。沉淀甲转化为沉淀乙的离子方程式是。