某研究小组在实验室中将工厂废弃的合金,经过一系列的反应,制得氯化铝固体、硝酸铜晶体和铁红。其实验方案如下:

(1)该小组所用的合金中含有的金属为铁、 、 (填名称)。
(2)操作①、③使用的主要玻璃仪器是_,简述操作②的方法: 。操作④实验操作步骤包括:加热浓缩、冷却结晶、 (填操作名称)、洗涤、干燥。
(3)写出滤渣B中较活泼金属与足量稀HN03后发生反应的离子方程式: ;
(4)若该小组通过上述实验流程制得铁红80g,假设实验过程中无质量损失,则合金中铁的质量为 g;
(5)上述实验流程中符合“绿色化学”理念的做法是 (答出一点即可)。
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池的总的离子反应反应方程式:
正极的电极反应式为:
当a极溶解的质量为5.4g时,有mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置(填“能”或“不能”)形成原电池,
若不能,请说明理由(若能该空不作答),
若能,该原电池的正极为;该原电池总的化学反应方程式为:
( 4分)烷基取代苯 R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到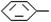 COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为 COOH的异构体共有7种,其中的3种是
COOH的异构体共有7种,其中的3种是 CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,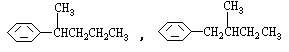
请写出其他4种的结构简式:
_________________、________________、_________________、___________________。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空: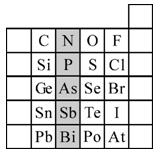
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是:(只写一种)
⑥阴影部分属于元素周期表中的族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2SHCl
③沸点:HFHCl
④还原性:I-Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A.常温下Se单质是气体
B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se
D.常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
A是在人们日常生活中最常见的有机物,75℅(体积分数)的水溶液可用于医疗消毒,并能进行如图所示的多种反应,通常情况下C是一种具有果香味的无色液体。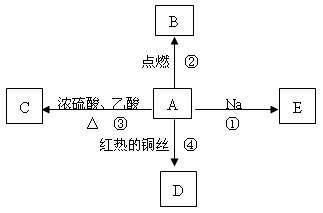

 (1)A的名称;C的分子式为。
(1)A的名称;C的分子式为。 (2)写出下列反应的化学方程式:
(2)写出下列反应的化学方程式: 反应②;
反应②; 反应④。
反应④。 (3)比较反应①与钠和水反应的现象有什么相同和不同:
(3)比较反应①与钠和水反应的现象有什么相同和不同: 相同点: ;
相同点: ; 不同点: 。
不同点: 。
取标况下11.2LC2H4在氧气中完全燃烧,120℃时将气体产物作如下处理,回答有关问题:
(1)若将气体先通过浓硫酸再通过碱石灰,碱石灰将增重______g。
(2)若将气体直接通过碱石灰,则碱石灰将增重______g。
(3)若将气体通过足量过氧化钠,则过氧化钠将增重_______g。
(4)C2H4可以和氢气反应生成C2H6,此反应属于反应,若将以上C2H4与氢气反应后的产物与足量的氯气进行光照,最多可以生成氯化氢气体mol。