按要求完成下列问题。
⑴.写出铅蓄电池放电时的总反应和两个电极反应及反应类型
放电总反应:
负极: ( )反应;
正极: ( )反应;
⑵.写出氯碱工业中电解饱和食盐水的总反应和两个电极反应及反应类型
电解总反应:
阳极: ( )反应;
阴极: ( )反应;
⑶.氢氧燃料电池中用KOH做电解质溶液,H2是还原剂,O2是助燃剂,写出正、负两极的电极反应
负极: 正极:
有下列各组物质
| A.O2和O3 |
| B.12C和13C |
C.CH3—CH2—CH2—CH3和 |
| D.H2O和D2O |
E.液氯和氯气
F.CO(NH2)2和NH4CNO
G.C60和金刚石
(1)组两物质互为同位素;
(2)组两物质互为同素异形体;
(3)组两物质互为同分异构体;
(4)组中两物质是同一物质。
(1)请写出下列微粒的电子式:Na2S,CO2;
(2)请写出下列微粒的结构式:O2,NH3;
(3)请写出下列微粒的结构示意图:Al3+,Cl。
(7分)按要求回答下列问题:
(1)向CH3COOH水溶液中加入水,平衡CH3COOH  H++CH3COO—将向(填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比(填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比(填“增大”、“减小”或“不变”)。
H++CH3COO—将向(填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比(填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比(填“增大”、“减小”或“不变”)。
(2)K通常表示化学平衡常数,对于反应Cl2+ H2O H++Clˉ+HClO其化学平衡常数K的表达式为:。
H++Clˉ+HClO其化学平衡常数K的表达式为:。
(3)下列说法中正确的是。
| A.pH=1和pH=2的盐酸,c(H+)之比为1︰2 |
| B.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系不可能为c(Cl-) > c(H+) > c(NH4+)>c(OH一) |
| C.0.1 mol·L-1的NaHCO3溶液中: c(Na+)>c(HCO3-) >c(CO32-) >c (H2CO3) |
| D.升高温度,弱电解质的电离常数一定增大 |
E.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b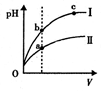
(5分)有机物A的结构简式为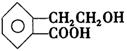 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。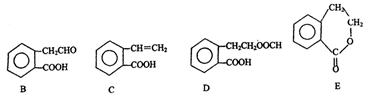
请回答下列问题:
(1)写出有机物A中官能团的名称:、。
(2)在A~D四种物质中,与E互为同分异构体的是(填代号)。
(3)写出有机物C发生加聚反应生成高分子化合物的化学方程式。
有机物A的结构简式为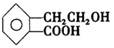 ,它可通过不同化学反应分别制得B、C、D 和E四种物质。
,它可通过不同化学反应分别制得B、C、D 和E四种物质。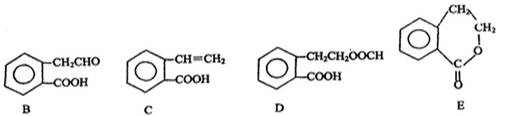
请回答下列问题:
(1)指出反应的类型:A→B,A→C。
(2)写出物质B。
(3)在A~E五种物质中,互为同分异构体的是(填代号)。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出由A生成E的化学方程式:。