常温下,将0.01 mol NH4Cl和 0.002 mol NaOH 溶于水配成1 L混合溶液,
!)该溶液中存在的三个平衡体系是:______________________________、
_______________________________、_______________________________。
溶液中共有_______种不同的粒子。
这些粒子中浓度为0.01 mol/L 的是_________,浓度为0.002 mol/L 的是_________。
(4)物质的量之和为0.01 mol的两种粒子是:___________和______________。
(5)_______和_______ 两种离子数量之和比OH-多0.008mol。
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。则:
①用太阳能分解10mol水消耗的能量是_____________kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________。
(3)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0 kJ·mol-1
CO(g)+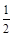 O2(g) =CO2(g),△H=-283.0 kJ·mol-1
O2(g) =CO2(g),△H=-283.0 kJ·mol-1
C(石墨)+O2(g) =CO2(g),△H=-393.5 kJ·mol-1
则4Fe(s)+3O2(g) =2Fe2O3(s),△H=。
[2012·潍坊一模]现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。已知A与D、C与F分别同主族,D、E、F、G同周期;A分别与B、C可形成含有10个电子的共价化合物分子,B的最外层电子数是其次外层电子数的2倍,且A、B的最外层电子数之和比C的最外层电子数少1;E位于B的前一主族。
请回答下列问题:
(1)元素G在周期表中的位置,F的原子结构示意图为。
(2)A、C、D三种元素组成一种常见化合物,该化合物所含的化学键类型为
,工业上利用某一个反应可同时生产该化合物和单质G,写出该反应的离子方程式。
(3)D、E元素的最高价氧化物所对应的水化物之间反应的离子方程式为
。
(4)含有E阳离子的盐常用作净水剂,其原因为。(用离子方程式表示)
[2012·淄博质检]X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下:
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可做光导纤维。
按要求回答下列问题:
(1)C的化学式为;X的化学式为。
(2)反应②的化学方程式为。
(3)反应⑦的离子方程式。
[2012·江苏卷]利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)  N2O3(g),其平衡常数表达式为K=________。
N2O3(g),其平衡常数表达式为K=________。
(2)上述工艺中采用气—液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是______________________;滤渣可循环使用,滤渣的主要成分是__________(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1∶1。若n(NO)∶n(NO2)>1∶1,则会导致_________________________;若n(NO)∶n(NO2)<1∶1,则会导致_________________________________。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为______________________________。
[2012·北京怀柔一模]金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下: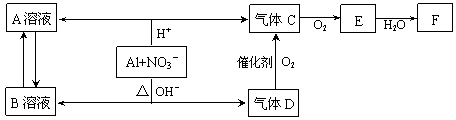
已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式。
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O—+。
(4)过量D的水溶液与A溶液反应的离子方程式是。
(5)D→C反应的化学方程式是。
(6)除去气体C中的杂质气体E的化学方法:(用化学方程式表示)。
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是。