[2012·潍坊一模]现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。已知A与D、C与F分别同主族,D、E、F、G同周期;A分别与B、C可形成含有10个电子的共价化合物分子,B的最外层电子数是其次外层电子数的2倍,且A、B的最外层电子数之和比C的最外层电子数少1;E位于B的前一主族。
请回答下列问题:
(1)元素G在周期表中的位置 ,F的原子结构示意图为 。
(2)A、C、D三种元素组成一种常见化合物,该化合物所含的化学键类型为
,工业上利用某一个反应可同时生产该化合物和单质G,写出该反应的离子方程式 。
(3)D、E元素的最高价氧化物所对应的水化物之间反应的离子方程式为
。
(4)含有E阳离子的盐常用作净水剂,其原因为 。(用离子方程式表示)
(1)下列反应中,属于放热反应的是_________。
| A.煤气化为水煤气 | B.Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑ |
| C.乙烯在氧气中燃烧 | D.高温煅烧石灰石使其分解 |
E.铝热反应F.葡萄糖在人体内氧化分解
(2)在化学上经常使用的氢核磁共振谱是根据不同化学环境的氢原子在氢核磁共振谱中
给出的信号不同来确定有机物分子中不同氢原子的。下列有机物分子在氢核磁共振谱中
给出两种信号的是。
①CH3Cl②CH3CH2OH③HCOOH④CH3COOCH3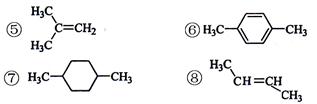
A为常见金属,D、E为常见非金属单质,D为黑色固体,E是常温下密度最小的气体,B、F是同种非金属化合物气体,A与氧气转化为C的过程中发出耀眼的白光,A→F之间的转化关系如图:按要求完成下列各题: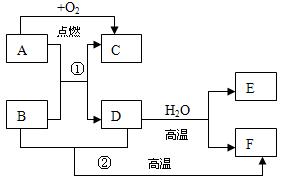
(1)写出A与F的化学式:A__________ F__________
(2)下列物质中有一种与B物质不属于同一类,其他与B均属于同一类,这一物质是_______
A.P2O5B.NOC.Na2O D.SiO2
(3)D高温情况下与水蒸气恰好完全反应生成E和F时,所得气体的平均相对分子质量是__________g/mol
(4)写出反应①的方程式:_______________________
有反应K2S+2FeCl3 ===2FeCl2+2KCl+S试设计一原电池;画出示意图(仪器、溶液选择有烧杯、FeCl3溶液, FeCl3溶液,K2S溶液,导线,KCl盐桥,石墨电极,小灯泡,导线等材料)标明所选溶液,电极;写出电极反应;
负极;
正极;
画出示意图;
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
k.Com]
(1)电解质溶液为稀H2SO4时,若灯 泡亮,则镁电极上发生的反应为:__________________________________;
泡亮,则镁电极上发生的反应为:__________________________________;
Al铝电极上发生的反应为:_________________________.
(2)电解质溶液为NaOH(aq)时,则
Mg电极上发生的反应为:_________________________;
Al电极上发生的反应为:___________________________.
总反应为:______________________________________.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为;
(2)反应开始至5min Z的平均反应速率为, X的转化率为;
(3)5min后Z的生成速率比5min末Z的生成速率大、小、相等)。