[2012·北京怀柔一模]金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下: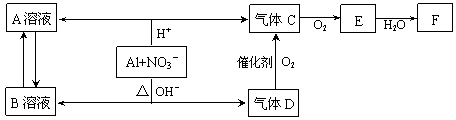
已知:气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题
(1)A和B两溶液混合产生白色沉淀,该白色沉淀的化学式 。
(2)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质的电子式 。
(3)完成并配平下列离子方程式:Al+NO3-+OH-+H2O— + 。
(4)过量D的水溶液与A溶液反应的离子方程式是 。
(5)D→C反应的化学方程式是 。
(6)除去气体C中的杂质气体E的化学方法: (用化学方程式表示)。
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
钙是人体神经.肌肉.骨骼系统.细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5克(相当于钙元素600毫克),成人每天服用1片。”
(1)“1.5克碳酸钙与600毫克的钙”的计量关系是如何得出来的,请列式表示
(2)该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1升溶液,取其20毫升,然后用0.01摩尔/升KMnO4 溶液滴定,反应中用去6毫升KMnO4溶液,发生的离子反应为:
2MnO4― +5H2C2O4 +6H+  2Mn2+ +10CO2↑+8H2O
2Mn2+ +10CO2↑+8H2O
①请通过计算回答该片剂中碳酸钙的含量。
②你认为该片剂的名称应该叫“钙尔奇D________片剂”。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由②和④组成,且②和④的质量比为3∶8的化合物的电子式是 ,
该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为
。
A、B、C、D、E均为可溶于水的固体,组成它们的离子有分别取它们的水溶液进行实验,结果如下: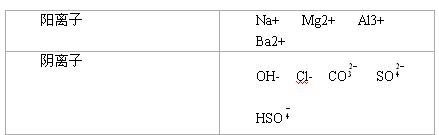
①A溶液与B溶液反应生成白色沉淀和气体,且沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀溶于E溶液且产生气体;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是:
A ;B ;C ;D ;E 。
(2)B溶液与过量D溶液反应的离子反应方程式________________ _
_________________________
在右下图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重6.4g。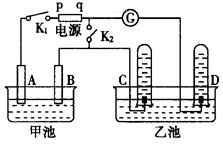
请回答下列问题:
(1)B电极发生反应的电极反应式。
C电极发生反应的电极反应式.
(2)甲池电解时反应的离子方程式。
(3)甲池电解后溶液的c(H+)为,要使电解后溶液恢复到电解前的状态,则需加入,其质量为g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定甲池原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论
①假设一:; ②假设二:。
②假设二:。
(5)若再将K1断开,闭合K2,灵敏电流计中指针是否会发生偏转?理由是什么?
电解原理在化学工业中有着广泛的应用。如图表示一个电解池,装有电解液a, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是。在X极附近观察到的现象是、。
②Y电极上的电极反应式是,检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电极反应式是。(说明:杂质发生的电极反应不必写出)