(12分)下列是A、B、C、D、E五种短周期元素的某些性质:
| |
A |
B |
C |
D |
E |
G |
| 最低化合价 |
-4 |
-2 |
-1 |
-2 |
-1 |
—3 |
| 电负性 |
2.55 |
2.58 |
3.16 |
3.44 |
3.98 |
3.0 |
(1)A原子的核外电子排布的轨道表示式_______,C原子的价电子排布式________
(2)A、B、C、G对应的最高价氧化物的水化物酸性最强的是 (写化学式)。
(3)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______ _(写化学式),
理由是________________________。
(4)A、B、D形成的氢化物沸点:________更高,热稳定性________更强(写化学式)。
(5)根据等电子原理(化学通式相同且价电子总数相等的分子或离子,结构相似),写出AD分子的结构式________。
(6)已知AG-与G2结构相似,推算HAG分子中σ键与π键数目之比为________。
(2分)已知Na与H2O发生反应:2Na +2H2O ="2NaOH" +H2↑,则4.6gNa溶于_______ g H2O中才能使溶液中Na+与H2O个数之比为1:10。
(12分,每空2分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: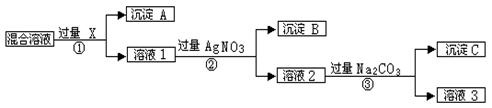 请回答下列问题:
请回答下列问题:
[1]写出实验流程中下列物质的化学式
试剂X :沉淀A:沉淀B:
[2]上述实验流程中加入过量的Na2CO3的目的是 _____。
[3]写出③的化学方程式:②________________________________________
[4]按此实验方案得到的溶液3中肯定含有(填化学式)杂质。
48g金属Mg与足量稀盐酸反应能生成________mol 的H2
下列物质中,物质的量最大的是________,含分子个数最多的是________,含原子个数最多的是________,质量最大的是________。
| A.6 g H2; | B.0.5 mol CO2; | C.1.20×1024个HCl分子; | D.148 g H2SO4; E.92 g乙醇(C2H5OH); F.4 ℃时10 mL水 |
( 10分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
(1)在地壳深处容易有气体逸出,在地壳浅处容易有沉积。
(2)如果上述反应的平衡常数K值变大,该反应(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为。