(1)①比较0.1mol/L的下列各种溶液的pH大小:CH3COONa_______NaClO;(填“>”、“<”或“=”)
②请按顺序排列出1mol/L (NH4)2SO4溶液中各种离子浓度大小关系______________。
③25℃时,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=10。混合溶液中由水电离出的c(H+)________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式________________
(3)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)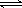 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K= 。
②该反应为 反应(选填吸热、放热)。
③能判断该反应是否达到化学平衡状态的依据是 。
(A)容器中压强不变 (B)混合气体中 [CO]不变
(C)v正(H2)=v逆(H2O) (D)C(CO2)=C(CO)
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:________________。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:_______________。
(3)简要叙述操作③的目的:________________________。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:___________。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度________________ (设整个过程中其它杂质不参与反应)。
已知氮元素有许多化合价,其化合价有-3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
通过分析上表可得出的结论是:当硝酸与金属M反应时,________________。
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是________。
(2)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示:
①该电池工作时的总反应为______ __
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。
在锌湿法冶炼过程中,会产生大量铜镉渣(主要含有Zn、Cd、Fe、Cu等),直接丢弃会造成环境污染,也是资源浪费,以下为回收处理铜镉渣制备硫酸锌晶体的工业流程:
已知:硫酸锌晶体易溶于水,难溶于酒精。
(1)加入硫酸的目的。
(2)硫酸不能溶出铜,加入锰粉是为了结合铁离子的变价来传递电子,将铜溶出,锰粉的主要成分为MnO2,相关方程式为2Fe3++Cu=2Fe2++Cu2+和。
(3)由硫酸锌溶液获得硫酸锌晶体,必要的操作方法为。
(4)制得的硫酸锌晶体需要洗涤,选择的试剂为,原因是。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑨ |
⑥ |
⑦ |
⑧ |
(1)由①、②两种元素组成的相对分子质量为28的有机物的空间构型是,
该物质与溴水发生加成反应的化学方程式是。
(2)用电子式表示④的简单氢化物的形成过程如下:;
(3) 请设计实验比较元素⑥与⑨金属性的相对强弱:_;
(4) 用①元素的单质与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:。
(5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应: 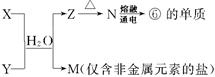
X溶液与Y溶液反应的离子方程式为,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式。
Ⅰ.下面列出了几组物质或粒子,请将合适的组号填写在空格上。
①金刚石与“足球烯”(C60);②D与T;③16O、17O和18O;④氧气(O2)与臭氧(O3);⑤乙醇(CH3CH2OH)和甲醚(CH3OCH3);
(1)是同素异形体的, (2)是同位素的,(3)是同分异构体的。
Ⅱ.在下列变化中:①干冰气化 ②硝酸钾熔化 ③食盐溶于水 ④HCl溶于水 ⑤蔗糖溶于水 ⑥HI分解。用序号填空:(1)未破坏化学键的是,(2)仅离子键被破坏的是,
(3)仅共价键被破坏的是。