银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为____mol CuAlO2(Cu 的相对原子量取63.5),至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
下表为元素周期表的—部分,请参照元素①一⑨在表中的位置,回答下列问题。
(1)第三周期中元素非金属性最强的元素的原子结构示意图是___________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是___________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________________。
(4)下列可以判断⑤和⑥金属性强弱的是______________________(填序号)。
A.单质的熔点⑤比⑥低B.化合价⑤比⑥低
C.单质与水反应⑤比⑥剧烈 D.最高价氧化物的水化物的碱性⑤比⑥强
(5)含有上述元素的物质间存在以下转化:
A.M的化学式是___________。
B.N生成⑥的单质反应的化学方程式是_________________________________。
某实验小组同学进行如下实验,以探究化学反应中的能量变化。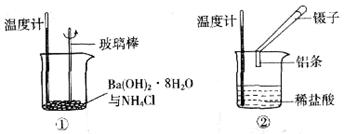
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验②中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是____________(填“吸热”或“放热”)反应,其能量变化可用下图中的____________(填“B”或“C”)表示。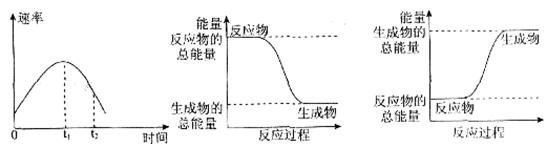
图A中0一tl段化学反应速率变化的原因是_________________________________。
Ⅰ.① H与
H与 H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷 ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______(填序号,下同)。(2)互为同系物的是______。
(3)互为同分异构体的是______。(4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。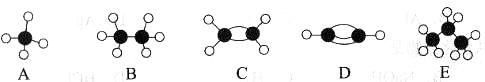
(1)D的化学式为__________________,A的二氯取代物有____________种。
(2)可作为植物生长调节剂的是________________________(填序号)。
聚乙烯醇Z是具有广泛用途的合成高分子材料,结构简式为 ,其工业合成路线如下:
,其工业合成路线如下: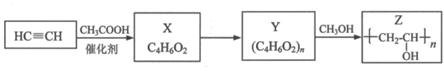
已知:下列反应中R,R',R"代表烃基
i. 
ii. 
回答下列问题:
(1)乙炔的空间构型是____________;
(2)X的结构简式是________________________;
(3)Y转化为Z的化学方程式是________________________;
(4)在一定条件下,也可用乙烯、氧气和乙酸制取X,该反应的化学方程式是_____________________;
(5)已知:
在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式。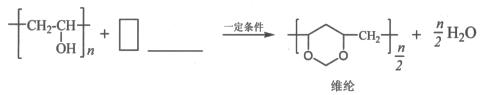
有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。
已知:有机物A的仪器分析如下:
①有机物A的质谱
②有机物A的红外光谱
③有机物A的核磁共振氢谱图上有2个吸收峰,峰面积之比是1:1。
回答下列问题:
(1)A的相对分子质量是____________;
(2)A含有官能团的名称是____________;
(3)A与氢氧化钠溶液在加热条件下反应的化学方程式是____________________________________;
(4)A有多种同分异构体,其中能与新制Cu(OH) 2共热,产生红色沉淀的有____________种,写出其中任意一种同分异构体的结构简式________________________。